

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{hh}=\frac{V}{22,4}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{CaCO_3}=\frac{m}{M}=\frac{30}{100}=0,3\left(mol\right)\)
Gọi x là số mol Ch4 ; y là số mol C2H6
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
x x
\(C_2H_6+\frac{7}{2}O_2\rightarrow2CO_2+3H_2O\)
y 2y
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0,3 0,3
Ta có hê phương trình
\(\hept{\begin{cases}x+y=0,2\\x+2y=0,3\end{cases}}\)
\(\Rightarrow\hept{\begin{cases}x=0,1\left(mol\right)\\y=0,1\left(mol\right)\end{cases}}\)
Vì Số mol hai chất bằng nhau nên thể tích hai chất cũng bằng nhau nên phần trăm thể tích mỗi chất là 50%

Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
1 → (x + 0,25y) x 0,5y
Thể tích và số mol tỉ lệ thuận nên thể tích bằng nhau thì số mol cũng bằng nhau
Theo đề bài: n(khí trước pứ) = n(khí sau pứ)
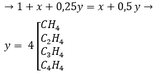

câu "Biết rằng trong A thể tích H2 gấp 2,5 lần thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất" là sao bạn , mình không hiểu ??

a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

Bài 4. Đốt cháy 28 ml hỗn hợp khí metan và axetilen cần phải dùng 67,2 ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điểu kiện nhiệt độ và áp suất).
Lời giải:
Đối với chất khí, trong cùng điều kiện về nhiệt độ và áp suất, tỉ lệ số mol trong phương trình phản ứng cũng là tỉ lệ về thể tích các khí.
a) Gọi thế tích của CH4 và C2H2 lần lượt là x, у (ml).
Phương trình phản ứng: CH4 + 2O2 → CO2 + 2H2O
p.ư: x -> 2x x (ml)
2C2H2 + 5O2 → 4CO2 + 2H2O
p.ư: у -> 2,5y 2y (ml)
Theo thể tích hỗn hợp và thể tích oxi, ta có hệ phương trình:
Giải (1) và (2), ta được x = 5,6ml và y = 22,4ml.
% =
x 100% = 20%; %
= 100% - 20% = 80%
b) Thể tích khí khí C02 sinh ra = x + 2y = 5,6 + 2 x 22,4 = 50,4ml.

a) Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C2H2 + 2Br2 —> C2H2Br4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH4 và CnH2n+2
Theo đề bài, VC2H2 tham gia phản ứng là : 0,896 – 0,448 = 0,448 (lít).
Vậy số mol C2H2 là 0,448\22,4=0,02(mol)
Gọi số mol của CH4 là X. Theo bài => số mol của CnH2n+2 cũng là x.
Vậy ta có : x+x=0,448\22,4=0,02⇒x=0,01
Phương trình hoá học của phản ứng.đốt cháy hỗn hợp :
2C2H2+5O2→4CO2+2H2O
0,02mol ---------------- 0,04mol
CH4+2O2→CO2+2H2O
0,01mol --------------0,02 mol
2CnH2n+2 + (3n+ 1) O2 —> 2nC02 + 2(n + 1)H20
0,01 mol --------------------------0,01 nmol
Vậy ta có :nCO2=0,04+0,01+0,01n=3,08\44⇒n=2
Công thức phân tử của hiđrocacbon X là C2H6.
b) Tính % thể tích các khí :
%VC2H2=0,448\0,896×100%=50%
%VCH4=%VC2H6=100%–50%\2=25%