Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
m H F = 200 . 40 100 = 80 (gam) => n H F = 80 20 = 4 (mol)
m C a F 2 = 4 . 1 2 . 78 . 100 80 = 195 (gam)

Chọn đáp án D
m H F = 400 . 40 100 = 160 (gam) → n H F = 160 20 = 8 (mol)
Bảo toàn F có: n H F = 2. n C a F 2 → n C a F 2 = 4 mol.
m C a F 2 = 4 , 78 80 % = 390 (gam)

mHF = 40 x 2,5 / 100 = 1kg.
Phương trình hóa học của phản ứng:
CaF2 + H2SO4 \(\rightarrow\) CaSO4 + 2 HF
nHF = 1/20 mol.
nCaF2 = 1/40 mol.
mCaF2 = 1/40 x 78 = 1,95.
mCaF2 cần dùng = 1,95 x 100 / 80 = 2,4375kg.
CaF2 + H2SO4 \(\Rightarrow\) CaSO4 + 2HF theo phương trình ta có: nCaF2=1/2nHF=0,025mol nCaF2 Cần dùng =0,025/80%=0,03125mol mCaF2 cần dùng =0,03125.78=2,4375g

mHF =\(\frac{40.2,5}{100}\) = 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 ---> CaSO4 + 2HF
78kg 40kg
X kg 1 kg
mCaF2 cần dùng: \(\frac{1.78}{40}.\frac{100}{80}\) = 2,4375 kg
mHF = = 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 CaSO4 + 2HF
78kg 40kg
X kg 1 kg
cần dùng:
= 2,4375 kg

Câu 1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x________x__(mol)
\(Al+2HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
y_____2y______y______3/2y__(mol)
\(n_{khí}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+\frac{3}{2}y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\frac{10,2-\left(24.0,2\right)}{0,2}.100\%=52,94\%\)
\(\%m_{Al}=100\%-52,94\%=47,06\%\)
\(m_{muoi}=95.0,2+133,5.0,2=28,6\left(g\right)\)
\(V_{HCl}=1,6\left(l\right)\)
Dùng 7,5% \(\Rightarrow V=1,6-1,6.7,5\%=1,48\left(l\right)\)
Câu 2:
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(n_{FeCl2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{AgCl}=2n_{FeCl2}=2.0,2=0,4\left(mol\right)\)
\(m_{AgCl}=0,4.143,5=57,4\left(g\right)\)
\(n_{Fe\left(NO3\right)2}=n_{FeCl2}=0,2\left(mol\right)\)
V dd sau phản ứng= VFeCl2 + VAgNO3 = 0,2+0,3= 0,5 (l)
\(\Rightarrow CM_{FeCl2}=\frac{0,2}{0,5}=0,4M\)

Chọn A
\(\hept{\begin{cases}\text{Mg, Al, Zn : x mol}\\\text{Fe : y mol}\end{cases}}\)\(\Rightarrow\)\(\hept{\begin{cases}\text{nx + 2y = 0,05.2}\\\text{nx + 2y = 2.}\left(\frac{\text{5,763 - 2}}{71}\right)\end{cases}}\)
\(\Rightarrow\)y = 0,006\(\Rightarrow\) %m\(_{Fe}\) = 16,8 %

Đáp án D
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60%=>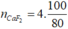 = 5 mol
= 5 mol
m = 5. (40+19.2) = 390 (g)
sao tính ra mHF =160g thế ạ ?