
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3

Trường hợp 2: phản ứng tạo ra 2 loại muối
SO2 + MOH \(\rightarrow\) MHSO3
x mol x mol
SO2 + 2MOH \(\rightarrow\) M2SO3 + H2O
y mol 2y mol y mol
nSO2 < nNaOH < 2nSO2 => 0,2 < a < 0,4
Ta có hệ phương trình: x+ y= nSO2 và x+ 2y =nMOH
=> y= nMOH - nSO2 = 0,4 - a= nH2O sinh ra
Theo định luật bảo toàn khối lượng:
mSO2 + mNaOH + mKOH = m chất tan + mH2O sinh ra
64.a+0,3.40+0,1.56 = 30,08 + 18.(0,4-a)
=> a= 0,24 ( thỏa mãn) => V= 5,376 lít
Xét phản ứng giữa hỗn hợp A với H2SO4 đặc
R2SO3 + H2SO4 \(\rightarrow\)R2SO4 + SO2 + H2O
2RHSO3 + H2SO4 \(\rightarrow\)R2SO4 + 2SO2+ H2O
Từ 2 phương trình trên ta thấy: nhỗn hợp A = nSO2= 0,24
Tính được M ( trung bình) của hỗn hợp A bằng 115
=> R + 81 < 115 < 2R + 80
=> 17,5 < R < 43
=> R là Na (M = 23)
Xét phản ứng giữa Na với dd HCl:
nNa= 0,5 mol; nHCl = 0,4 mol
Nadư + HClhết \(\rightarrow\) NaCl + H2O
0,4 mol 0,4 mol 0,4 mol
nNadư = 0,5-0,4 = 0,1 mol
2Na + 2H2O \(\rightarrow\) 2NaOH + H2
0,1 mol 0,1 mol
Dung dịch Y chứa: 0,4 mol NaCl và 0,1 mol NaOH
NaCl + AgNO3 \(\rightarrow\) AgCl + NaNO3
0,4 mol 0,4 mol
NaOH + AgNO3\(\rightarrow\)AgOH+ NaNO3
0,1 0,1
2AgOH\(\rightarrow\)Ag2O + H2O
0,1 0,05
Kết tủa thu được gồm 0,4 mol AgCl và 0,05 mol Ag2O có tổng khối lượng là 69 gam
- PTHH: 2Al + 3H2SO4 \(\rightarrow\) Al2 (SO4)3 + 3H2 (1)
MgO + H2SO4 \(\rightarrow\) MgSO4 + 2HO (2)
2NaOH+ H2SO4 \(\rightarrow\) Na2SO4 + 2H2O (3)
2NaOH+ MgSO4 \(\rightarrow\) Mg(OH)2 + Na2SO4 (4)
6NaOH+ Al2(SO4)3\(\rightarrow\) 3Na2SO4 + 2Al(OH)3 (5)
NaOH + Al(OH)3 \(\rightarrow\) NaAlO2 + 2H2O (6)
Mg(OH)2 \(\rightarrow\) MgO + H2O (7)
CO2 + NaOH \(\rightarrow\) NaHCO3 (8)
CO2 + NaAlO2 + 2H2O \(\rightarrow\) Al(OH)3 + NaHCO3 (9)
nH2SO4= \(\dfrac{163,68.28,74}{100.98}\)= 0,48 mol
Ta có: nH2 = \(\dfrac{6,048}{22,4}\)= 0,27 mol
Theo (1): nAl= \(\dfrac{2}{3}\)0,27 = 0,18 mol
- Ta coi dung dịch Y có 2 phần: + Phần 1 là dd Y ban đầu
+ Phần 2 là dd Y có khối lượng 100g
Kết tủa T là Al(OH)3 có số mol = 9,36/37 = 0,12 mol
Gọi k là tỉ số giữa phần 1 và phần 2
Suy ra k= 0,18/0,12= 1,5
\(\Rightarrow\) \(\dfrac{m+163,68-0,54}{120}\)= 1,5
\(\Rightarrow\) m= 16,86 (gam)
- Ở phần 1: mol axit dư= (16,86 + 163,68 - 0,54). 4,9/(100.98)= 0,09 mol
\(\rightarrow\) mol axit pư với MgO= mol MgO = 0,48-0,27-0,09 = 0,12 mol
Vậy phần trăm về khối lượng từng chất trong hỗn hợp ban đầu là:
%mAl = \(\dfrac{0,18.27}{16,86}\)100% = 28,82%
%mMgO= \(\dfrac{0,12.40}{16,86}\)100%= 28,47%
%mMgSO4 = 100% - 28,82% - 28,47% = 42,71%
Tìm x: Tổng mol MgSO4 trong dd Y ban đầu là
nMgSO4 = nMgO + nMgSO4 (bd)
= 0,12 + (16,9860 - 4,86- 4,8) : 120 = 0,18 mol
Do: nMgSO4 (p1) = 1,5n MgSO4 (p2)
Ở phần 1 của dung dịch Y:
\(\Rightarrow\)MgSO4 (p2) = \(\dfrac{0,18}{1,5}\)= 0,12 mol
Theo PT (4,7)
a=mMgO = 0,12.40 = 4,8 gam
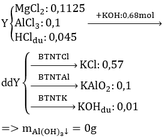
nNaOH= 0,3 mol; nKOH= 0,1 mol
Xết pư giữa a mol SO2 với dd chứa 0,3 mol NaOH và 0,1 mol KOH ( quy về MOH: 0,4 mol)
+ Trường hợp 1: MOH dư
SO2 + 2MOH \(\rightarrow\)M2SO3 + H2O
a 2a a
nH2O sinh ra= a mol và 2a < 0,4 => a <0,2
Theo ĐLBTKL:
mSO2 + mNaOH + mKOH = m chất tan + mH2O sinh ra
64.a+ 0,3.40 + 0,1.56 = 30,08 + a.18
=> a= 0,27 ( vô lý)

Hoà tan hoàn toàn 18,2g hỗn hợp gồm Al2O3 và MgO bằng một lượng vừa đủ dung dịch H2SO4 4,9%. Thu được 58,2g hỗn hợp 2 muối.
a) Tính khối lượng mỗi muối thu được
b) Tính khối lượng dung dịch H2SO4 cần dùng
---
a) Gọi x,y lần lượt là số mol Al2O3, MgO. (x,y>0)
PTHH: Al2O3 + 3 H2SO4 -> Al2(SO4)3 + 3 H2O
x____________3x_______x(mol)
MgO + H2SO4 -> MgSO4 + H2O
y______y______y(mol)
=> \(\left\{{}\begin{matrix}102x+40y=18,2\\342x+120y=58,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
mAl2(SO4)3= 342x=34,2(g)
=> mMgSO4= 58,2-34,2=24(g)
b)mH2SO4= (3x+y).98=0,5.98=49(g)
=>mddH2SO4=(49.100)/4,9=1000(g)

Nhận xét :
- Al có tính khử mạnh hơn Fe, Ag+ có tính oxi hóa mạnh hơn Cu2+ nên Al sẽ tác dụng với Ag+ trước và phản ứng cứ tiếp tục xảy ra.
- Dung dịch sau phản ứng không thấy màu xanh chứng tỏ Cu2+ hết (Ag+ hết) . Chất rắn sau phản ứng không tác dụng với dung dịch HCl, có nghĩa là trong chất rắn Z chỉ có Ag và Cu sinh ra; Al, Fe tham gia phản ứng hết.
Vậy, các chất đều tham gia phản ứng vừa đủ với nhau. Áp dụng định luật bảo toàn electron, viết các bán phản ứng, ta sẽ ra được đáp số.

Pư: Mg+2HCl -> MgCl2 +H2
MgO+2HCl-> MgCl2 +H2O
MgCl2+2NaOH-> Mg(OH)2↓+2NaCl
Mg(OH)2-> MgO+H2O
nMgO=14/40=0.35 mol
-> nMg(OH)2=nMgCl2=nMgO=0.35 mol
-> nMgO=nMg=nMgCl2=0.35 mol
gọi x,y lần lượt là số mol của Mg,MgO
->mhh=24x+40y=2 (1)
nMgCl2=x+y=0.35 (2)
giải hệ (1)(2) có x=0.103125
y=0.246875
- khối lượng của bạn nhập sai vì klg hỗn hợp quá nhỏ

nH2 = \(\frac{1,68}{22,4}\) = 0,075 (mol)
Mg + 2HCl \(\rightarrow\) MgCl2 + H2\(\uparrow\) (1)
0,075 <--------0,075 <--0,075 (mol)
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
%mMg= \(\frac{0,075.24}{5,8}\) . 100% = 31,03 %
%m MgO = 68,97%
nMgO = \(\frac{5,8-0,075.24}{40}\) = 0,1 (mol)
Theo pt(2) nMgCl2 = nMgO= 0,1 (mol)
mdd sau pư = 5,8 + 194,35 - 0,075.2 = 200 (g)
C%(MgCl2) = \(\frac{95\left(0,075+0,1\right)}{200}\) . 100% = 8,3125%

\(\text{Ta có FeSO4(a mol) MgSO4(b mol) K2SO4( c mol)}\)
\(\text{a+b+c=4b}\)
\(\Rightarrow\text{a-3b+c=0}\)
\(\Rightarrow\left\{{}\begin{matrix}\text{152a+120b+174c=88,05}\\\text{127a+95b+149c=73,05}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{a=0,375}\\\text{b=0,15 }\\\text{ c=0,075}\end{matrix}\right.\)
\(\text{VBaCl2=0,6/2=0,3(l) }\)
\(\Rightarrow\text{mBaSO4=0,6x233=139,8(g)}\)
b, \(\Rightarrow\left\{{}\begin{matrix}\text{mFeSO4=57(g)}\\\text{mMgSO4=18(g)}\\\text{mK2SO4=13,05(g)}\end{matrix}\right.\)
c,\(n_{KOH}=0,9\left(mol\right)\)
\(PTHH:\text{FeCl2+2KOH}\rightarrow Fe\left(OH\right)2+2KCl\)
\(\text{4Fe(OH)2+O2+2H2O}\rightarrow4Fe\left(OH\right)3\)
\(\text{2Fe(OH)3}\rightarrow Fe2O3+3H2O\)
\(\text{MgCl2+2KOH}\rightarrow Mg\left(OH\right)2+KCl\)
\(\text{Mg(OH)2}\rightarrow MgO+H2O\)
=>FeCl2 dư
m=0,15x40+0,15x160=30(g)