Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Các phương trình phản ứng :
Phương trình phản ứng :
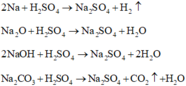
Hỗn hợp khí H2 và CO2
Dung dịch Y chỉ có Na2SO4 =>muối thu được khi cô cạn dung dịch Y là Na2SO4
Tinh toán:
Muối thu được là Na2SO4

Sơ đồ phản ứng :
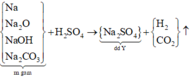
Bảo toàn gốc SO4 ta có :
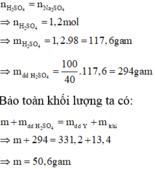

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

a,
Khối lượng chất rắn hh giảm 1 nửa
=> Y đứng sau H, X đứng trước H
\(m_X=m_Y=\frac{4,32}{2}=2,16\left(g\right)\)
\(n_{H2}=0,12\left(mol\right)\)
\(2X+nH_2SO_4\rightarrow X_2\left(SO_4\right)_n+nH_2\)
\(\Rightarrow n_X=\frac{0,24}{n}\left(mol\right)\)
\(M_X=\frac{2,16n}{0,24}=9n\)
\(n=3\Rightarrow M_X=27\left(Al\right)\)
\(n_{SO2}=\frac{2.0,112}{0,082.273}=0,01\left(mol\right)\)
\(2Y+2mH_2SO_4\rightarrow Y_2\left(SO_4\right)_m+mSO_2+2mH_2O\)
\(n_Y=\frac{0,02}{m}\left(mol\right)\)
\(M_Y=\frac{2,16m}{0,02}=108m\)
\(m=1\Rightarrow M_Y=108\left(Ag\right)\)
b,\(n_{Ag2SO4}=\frac{n_Y}{2}=0,01\left(mol\right)\)
\(Ag_2SO_4+Na_2S\rightarrow Na_2SO_4+Ag_2S\)
\(\Rightarrow n_{Na2S}=n_{Ag2S}=0,01\left(mol\right)\)
\(m=0,01.78.100:23,4\%=333,33\left(g\right)\)
\(\Rightarrow x=0,01.248=2,48\left(g\right)\)

Câu 1 :\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12(mol)\)
MgCO3 + 2HCl \(\to\) MgCl2 + CO2 + H2O
..................................0,12........0,12..................(mol)
Suy ra: a = 0,12.95 = 11,4(gam)
Câu 2 :
\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow n_{Cu} = 2n_{Fe} = 0,15.2 = 0,3(mol)\\ 2Fe+3Cl_2\xrightarrow{t^o} 2FeCl_3\\ Cu+Cl_2 \xrightarrow{t^o} CuCl_2\\ n_{Cl_2} = \dfrac{3}{2}n_{Fe} + n_{Cu} = 0,525\\ \Rightarrow V = 0,525.22,4 =11,76(lít)\)

1.
a)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , HNO3 (nhóm 1 )
Quỳ tím chuyển thành màu xanh : KOH , Ba(OH)2 ( nhóm 2 )
Quỳ tím không xảy ra hiện tượng : NaCl và NaNO3 (nhóm 3 )
*Cho AgNO3 vào ( nhóm 1 ) ta được :
Kết tủa trắng : HCl
\(AgNO3+HCl\rightarrow AgCl\downarrow+HNO3\)
Không xảy ra hiện tượng : HNO3
*Cho AgNO3 vào (nhóm 3) ta được :
Kết tủa trắng : NaCl
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
Không xảy ra hiện tượng :NaNO3
*Cho H2SO4 vào ( nhóm 2) ta được :
Kết tủa trắng : Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Không xảy ra hiện tượng : KOH
b)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , H2SO4 (nhóm 1)
Quỳ tìm chuyển thành màu xanh : NaOH
Không xảy ra hiện tượng :NaCl , NaBr ; NaI (nhóm 2)
*Cho AgNO3 vào (nhóm 1) ta được
Kết tủa trắng HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Không xảy ra hiện tượng H2SO4
Cho AgNO3 vào (nhóm 3) ta được
Kết tủa trắng là : NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Chuyển thành màu vàng nhạt là :NaBr
\(AgNO3+NaBr\rightarrow AgBr\downarrow+NaNO_3\)
Chuyển thành màu vàng : NaI
\(AgNO_3+NaI\rightarrow AgI\downarrow+NaNO_3\)
2.
Cho hỗn hợp X vào HCl chỉ có Fe phản ứng:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)=n_{Fe}\)
Cho X tác dụng với Cl2
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(\rightarrow n_{FeCl3}=n_{Fe}=0,02\left(mol\right)\)
\(\rightarrow m_{FeCl3}=0,02.\left(56+35,5.3\right)=3,25\left(g\right)\)
\(m_{CuCl2}=7,3-3,25=4,05\left(g\right)\)
\(\rightarrow n_{CuCl2}=\frac{4,05}{64+35,5.2}=0,03\left(mol\right)=n_{Cu}\)
\(\rightarrow m=m_{Fe}+m_{Cu}=0,02.56+0,03.64=3,04\left(g\right)\)
3.
Gọi số mol Al là x; Fe là y
\(\rightarrow27x+56y=8,3\left(g\right)\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Fe}=1,5x+y=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Giải được \(x=y=0,1\)
\(\rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
\(\rightarrow\%m_{Al}=\frac{2,7}{8,3}=32,5\%\rightarrow\%m_{Fe}=100\%-32,5\%=67,5\%\)
Ta có muôí gồm AlCl3 và FeCl2
\(\rightarrow m_{muoi}=0,1.\left(27+35,5.3\right)+0,1.\left(56+35,5.2\right)=20,05\left(g\right)\)
b) Ta có: nHCl phản ứng=2nH2=0,5 mol
\(n_{HCl_{tham.gia}}=0,5.120\%=0,6\left(mol\right)\)
\(\rightarrow V_{HCl}=\frac{0,6}{1}=0,6\left(l\right)\)

1,\(n_{hhB}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(d_{\frac{hhB}{H_2}}=\frac{\overline{M}}{2}=8\Rightarrow\overline{M}=16\)
ta có sơ đồ dường chéo:
H 2 NO = 2 30 16 14 14
=>\(\frac{n_{H_2}}{n_{NO}}=1\Rightarrow n_{H_2}=n_{NO}=0,25\left(mol\right)\)
ta có các quá trình nhường nhận e:
\(Mg^0\rightarrow Mg^{+2}+2e\) \(Al^0\rightarrow Al^{+3}+3e\)
\(N^{+5}+3e\rightarrow N^{+2}\) \(2H^{+1}+2e\rightarrow H_2^0\)
0,25................0,25 0,25
mNO3=0,25.62=15,5(g)
mSO4=0,25.96=24(g)
=>mmuối=mkl+mNO3+mSO4=8,5+15,5+24=48(g)
Chọn D