Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Số mol HCl dư =0,1 (mol)
Số mol kết tủa
![]()
Số mol ![]()
Số mol HCl ban đầu = 3 . 0 , 1 + 0 , 1 = 0 , 4 ⇒ a = 2

Giải thích:
X gồm HCl dư (x mol) và AlCl3 (y mol)
=> x = 0,1 mol
+ Tại nNaOH = 0,25 mol: nNaOH = nHCl + 3nAl(OH)3 => nAl(OH)3 = (0,25-0,1)/3 = 0,05 mol
+ Tại nNaOH = 0,45 mol: nNaOH = nHCl + 4nAl3+ - nAl(OH)3 => 0,45 = 0,1 + 4y – 0,05 => y = 0,1 mol
BT “Cl” => nHCl = 3nAlCl3 + nHCl dư => nHCl = 0,1 + 3.0,1 = 0,4 mol
=> a = 0,4/0,2 = 2M
Đáp án A

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Gọi công thức của Oxit Sắt là : \(Fe_xO_y\)
Các PTHH khi X vào HCl :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)(1)
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\frac{2y}{x}}+yH_2O\) (2)
nHCl ban đầu =\(\frac{200.14,6}{100.36,5}=0.8\left(mol\right)\)
\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow m_{H_2}=0,1.2=0,2\left(g\right)\)
Từ (1) \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_xO_y}=17,2-5,6=11,6\left(g\right)\Rightarrow n_{Fe_xO_y}=\frac{11,6}{56x+16y}\left(mol\right)\left(3\right)\) Từ (1) \(n_{HCl}=2n_{H_2}=2.0,1=0,2\left(mol\right)\)
\(m_{ddA}=200+17,2-0,2=217\left(g\right)\)
\(m_{ddB}=217+33=250\left(g\right)\)
\(n_{HCldu}=\frac{250.2,92}{100.36,5}=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,8-0,2-0,2=0,4\left(mol\right)\)
\(n_{Fe_xO_y}=\frac{1}{2y}n_{HCl}=\frac{1}{2y}.0,4=\frac{0,2}{y}\left(mol\right)\)(4)
Từ (3) và (4) ta có pt :\(\frac{11,6}{56x+16y}=\frac{0,2}{y}\Rightarrow\frac{x}{y}=\frac{3}{4}\)
Vậy CT Oxit cần tìm là :Fe3O4

Đáp án A
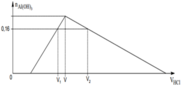
Quy đổi hỗn hợp X thành Al2O3 và K2O với mHỗn hợp = 20,48 + 0,18×16 = 23,36 gam.
Sơ đồ ta có:
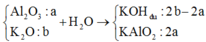
![]()
⇒ nHCl ứng với V1 = (2b – 2a) + 0,16.
⇒ nHCl ứng với V2 = (2b – 2a) + 2a + (2a–0,16)×3 = 6a + 2b – 0,48
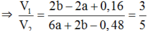
⇔ 28a – 4b = 2,24 (2)
+ Giải hệ (1) và (2) ⇒ nAl2O3 = 0,1 và nK2O = 0,14.
⇒ Số mol HCl cần để tạo kết tủa cực đại = 2b – 2a + 2a = 2b = 0,28 mol.
⇒ VHCl = 0 , 28 1 = 0,28 lít = 280 ml

Giải thích:
2Na + 2H2O → 2NaOH + H2
2NaOH + Al2O3 → 2 NaAlO2 + H2O
Y dư NaOH
Thì HCl + NaOH → NaCl + H2O
HCl + NaAlO2 +H2O → NaCl + Al(OH)3
3HCl + Al(OH)3 → AlCl3 + 3H2O
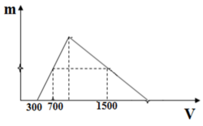
Y có nNaOH = 0,3 mol và nNaAlO2 = a mol
Khi thêm 700 ml dung dịch HCl vào thì n↓ = 0,7 - 0,3 = 0,4 mol
Khi thêm 1500 ml dung dịch HCl vào thì n↓= a – (1,5 – 0,3 –a ): 3
→ a – (1,5 – a – 0,3) : 3 = 0,4 (mol) → a = 0,6 mol
→ bảo toàn Na có nNa = a + 0,3 = 0,9 mol → nH2 = 0,45 mol → x =0,45 . 22,4 = 10,08
Đáp án D

Xét trường hợp Al dư: 2Al + Cr2O3 → 2Cr + Al2O3 (chọn ẩn cho mỗi phần)
2x x
Gọi y là số mol Al dư → 52.2x + 102x + 27y = 46,6:2 ; y + 2x = 0,3 → x = y = 0,1 mol.
Bảo toàn điện tích: nHCl = 6nAl2O3 + 3nAl3+ + 2nCr2+ = 1,3 mol.
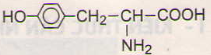 với các chất sau:
với các chất sau: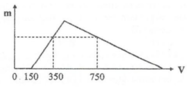

Giải thích:
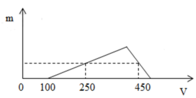
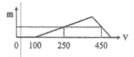
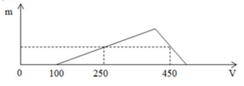
Ta chia đồ thị làm 3 giai đoạn
Giai đoạn 1: bắt đầu xuất hiện kết tủa => hết VNaOH = 100 ml => đây là lượng thể tích cần dùng để trung hòa lượng HCl còn dư sau phản ứng
=> nHCl dư = 0,1 (mol)
Giai đoạn 2: đồ thi bắt đầu đi lên đến điểm cực đại
Tại giai đoạn này xảy ra phản ứng:
Al3+ + 3OH- → Al(OH)3↓
(0,25 – 0, 1) → 0,05 (mol)
Giai đoạn 3: đồ thị đi xuống, tại giai đoạn này lượng kết tủa bị hòa tan theo phản ứng
Al(OH)3 + OH- → AlO2− + 2H2O
Từ đồ thị ta thấy tại giá trị VNaOH = 250 ml và VNaOH = 450 ml cùng thu được một lượng kết tủa như nhau
=> áp dụng công thức nhanh ta có:
nNaOH = 4nAl3+ - nAl(OH)3 + nH+ dư
=> 0,45 = 4a – 0,05 + 0,1
=> a = 0,1 (mol)
Vậy để lượng kết tủa cực đại thì tất cả lượng Al3+ sẽ chuyển hết thành Al(OH)3
=> nAl(OH)3 = nAl3+ = 0,1 (mol) => mAl(OH)3 = 0,1.78 = 7,8(g)
Đáp án D