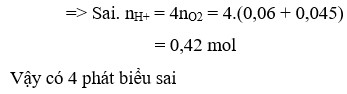Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. - dùng quỳ tím: hóa đỏ khi tiếp xúc với H2SO4. ko đổi màu khi tiếp xúc với NaCl.
- dùng dd BaCl2: tạo kết tủa BaSO4 với H2SO4. ko pư với NaCl.
- dùng dd AgNO3: tạo kết tủa AgCl với NaCl. ko pư với H2SO4.
- dùng Fe: tạo khí khi cho vào H2SO4. ko pư với NaCl

Bài 2 :
a_)
Theo đề bài ta có : \(\left\{{}\begin{matrix}nCaO=\dfrac{11,2}{56}=0,2\left(mol\right)\\nkt=nCaCO3=\dfrac{2,5}{100}=0,025\left(mol\right)\end{matrix}\right.\)
Ta có PTHH :
CaO + H2O \(->\) Ca(OH)2 ( dd A là Ca(OH)2 )
0,2mol....................0,2mol
* Xét TH 1 : Bazo còn dư sau pư => tính theo nkt
Ta có PTHH :
\(Ca\left(OH\right)2+CO2->CaCO3\downarrow+H2O\)
0,025mol..........0,025mol......0,025mol
=> \(V_{CO2\left(tham-gia-p\text{ư}\right)}=0,025.22,4=0,56\left(l\right)\)
* Xét TH2 : Bazo pư hết , kết tủa còn dư sau pư
PTHH :
Ca(OH)2 + Co2 \(->CaCO3\downarrow+H2O\)
0,2mol.........0,2mol........0,2mol
mà : nCaCO3(bđ) = nkt(bđ) = 0,025 mol , theo PTHh nCaCO3(tham gia pư) = 0,2 (mol) => chứng tỏ 0,175 mol CaCO3 đã tiếp tục tham gia pư với CO2
PTHH :
CaCO3 + CO2 + H2O \(->\) Ca(HCO3)2
0,175mol..0,175mol
=> V\(_{CO2\left(tham-gia\right)}=22,4.\left(0,2+0,175\right)=8,4\left(l\right)\)
b_) ( ko chắc chắn )
* TH1 : D\(_{M\text{ax}}\)
Gọi x ,y lần lượt là số mol của MgCo3 và BaCO3
PTHH :
\(MgCO3+2HCl->MgCl2+CO2\uparrow+H2O\)
xmol.................................................xmol
BaCO3 + 2HCl \(->\) MgCl2 + CO2\(\uparrow\) + H2O
y mol............................ymol.......ymol
DD A là CaCO3 có n = 0,2 mol => nCO2 = 0,2 mol ( theo PTHH ở câu a)
Ta có HPT :\(\left\{{}\begin{matrix}x+y=0,2\\84x+197y=28,1\end{matrix}\right.\)
Giải ra ta được : \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
=> %mMgCO3 = a = \(\dfrac{0,1.84}{28,1}.100\%\approx29,9\%\)
Vậy D\(_{M\text{ax}}\) khi a = 29,9%
*TH2 : \(D_{min}\)
+ Giả sử hh chỉ có MgCO3 => nCO2 = nMgCO3 = \(\dfrac{28,1}{84}\approx0,336\left(mol\right)\) => a= 100%
+ Giả sử hh chỉ có BaCO3 => nCo2 = nBaCO3 = \(\dfrac{28,1}{197}\approx0,143\left(mol\right)=>a=0\%\)
Vậy \(D_{Min}\) khi a = 100%
P/S :Có vấn đề gì xin liên hệ với em qua Facebook(profile.php) hoặc ngay trên này nha( muongthinh )
1/
Trả lời : có 2 cách sắp xếp
cách 1 :A là kiềm dư . VD : NaOH dư
B là \(Fe_3O_4\)
\(Al_2O_3+2NaOH_{dư}-->2NaAlO_2+H_2O\)
\(SiO_2+2NaOH_{dư}-->Na_2SiO_3+H_2O\)
cách 2 : A là axit , B là SiO2
\(Fe_3O_4+8HCl-->FeCl_2+2FeCl_3+4H_2o\)
\(Al_2O_3+6HCl-->2AlCl_3+3H_2O\)

Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
||→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
||→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
||→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
||→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
||→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
||→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.