Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 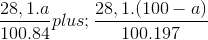 = 0,2
= 0,2
=> a = 29,89.

Chọn đáp án D.
Các thí nghiệm có kết tủa là:
a – b – c – f – g. Các thí nghiệm
d và e ban đầu có kết tủa nhưng
bị tan.
(a). Có kết tủa Cu(OH)2.
(b). Có kết tủa CuS.
(c). Có kết tủa BaSO4.
(f). Có kết tủa BaSO4.

- Từ dung dịch AgNO3 có 3 cách để điều chế Ag:
+ Dùng kim loại có tính khử mạnh hơn để khử ion Ag+.
Cu + 2 AgNO3 → Cu(NO3)2 + 2Ag
+ Điện phân dung dịch AgNO3:
4AgNO3 + 2H2O 4Ag + O2 + 4HNO3
+ Cô cạn dung dịch rồi nhiệt phân AgNO3:
2AgNO3 2Ag + 2NO2 + O2
- Từ dung dịch MgCl2 điều chế Mg: chỉ có một cách là cô cạn dung dịch để lấy MgCl2 khan rồi điện phân nóng chảy:
MgCl2 Mg + Cl2.
\(4AgNO_3+2H_2O\) \(\underrightarrow{dpdd}\) \(4Ag+O_2\uparrow+4HNO_3\)
\(2AgNO_3\) \(\underrightarrow{t^o}\) \(2Ag+2NO_2+O_2\)
\(MgCl_2\) \(\underrightarrow{dpnc}\) \(Mg+Cl_2\)

-\(n_{Fe}=\frac{11,2}{56}=0,2mol\) \(n_{Al}=\frac{m}{27}mol\) |
-khi thêm \(Fe\) vào cốc đựng \(HCl\) ( cốc A ) có phản ứng: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) 0,2 0,2 |
theo định luật bảo toàn khối lượng, khối lượng cốc \(HCl\) tăng thêm: \(11,2-\left(0,2.2\right)=10,8g\) |
khi thêm \(Al\) vào cốc đựng dd \(H_2SO_4\) có phản ứng: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) \(\frac{m}{27}mol\) \(\rightarrow\) \(\frac{3.m}{27.2}mol\) |
| khi cho \(m\) gam \(Al\) vào cốc B, cốc B tăng thêm : \(m-\frac{3.m}{27.2}mol\) |
để cân thăng bằng, khối lượng ở cốc đựng \(H_2SO_4\) cũng phải tăng thêm 10,8g.Có: \(m-\frac{3.m}{27.2}.2=10,8\)
|
| giải ra được \(m=\) \(\left(g\right)\) |

Đáp án C
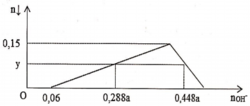
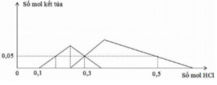
TN1 : Nhỏ từ từ HCl vào hỗn hợp x mol NaOH và y mol Na2ZnO2 ta thấy tới 0,1 mol HCl mới thấy xuất hiện kết tủa. Do vậy 0,1 mol HCl này dùng để trung hoà NaOH →x=0,1.
Khi dùng 0,3 mol HCl thì thu được 0,05 mol kết tủa Zn(OH)2 và đồ thị đang đi xuống tức đang hoà tan kết tủa.
Để toạ thành kết tủa lúc đồ thị đi lên thì cần 0,1 +0,05.2=0,2 mol HCl.
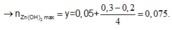
TN2 : Cho HCl vào z mol Ba(OH)2 và t mol Ba(AlO2)2.
Khi dùng tới 0,3 mol HCl mới chỉ xuất hiện 0,05 mol kết tủa Al(OH)3 trong lúc đang tạo kết tủa.
Do vậy ![]()
Khi dùng 0,3 hay 0,5 mol đều thu được 0,05 mol kết tủa
![]()

Đáp án B
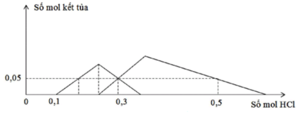
TN1 : Nhỏ từ từ HCl vào hỗn hợp x mol NaOH và y mol Na2ZnO2 ta thấy tới 0,1 mol HCl mới thấy xuất hiện kết tủa. Do vậy 0,1 mol HCl này dùng để trung hoà NaOH → x = 0,1.
Khi dùng 0,3 mol HCl thì thu được 0,05 mol kết tủa Zn(OH)2và đồ thị đang đi xuống tức đang hoà tan kết tủa.
Để toạ thành kết tủa lúc đồ thị đi lên thì cần 0,1 +0,05.2=0,2 mol HCl.
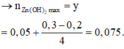
TN2 : Cho HCl vào z mol Ba(OH)2 và t mol Ba(AlO2)2.
Khi dùng tới 0,3 mol HCl mới chỉ xuất hiện 0,05 mol kết tủa Al(OH)3 trong lúc đang tạo kết tủa.
Do vậy
![]()
Khi dùng 0,3 hay 0,5 mol đều thu được 0,05 mol kết tủa
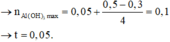



Đáp án D
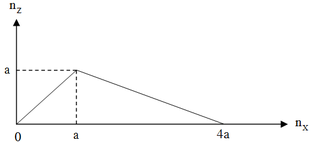
Dựa vào đồ thị, ta thấy: Khi cho từ từ X vào dung dịch Y, phản ứng thứ nhất tạo kết tủa Z và lượng kết tăng dần đến cực đại là a mol, phản ứng này cần dùng a mol X. Phản ứng thứ hai hòa tan từ từ kết tủa Z đến hết, phản ứng này cần 3a mol chất X.
Suy ra: Đây là thí nghiệm cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
Phương trình phản ứng:
H C l + N aA l O 2 + H 2 O → A l ( O H ) 3 ↓ ( 1 ) m o l : a ← a → a 3 H C l + A l ( O H ) 3 → A l C l 3 + 3 H 2 O ( 2 ) m o l : 3 a ← a