Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Giả sử kiềm có công thức chung là MOH (M=(0,1.23+0,05.39)/0,15=85/3)
Nếu phản ứng chỉ tạo 1 muối:
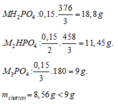
=> MOH dư, phản ứng tạo muối M3PO4.
Đặt nM3PO4=x mol, nMOH=y mol;
180x+136y/3=8,56
3x+y=nMOH=0,15
=> x=0,04, y=0,03.
=> nP2O5=0,04/2=0,02 mol
=> mP2O5=2,84 gam.

Đáp án B
Giả sử dung dịch kiềm có công thức chung là: MOH: 0,15 (mol) với
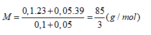
+ Nếu phản ứng chỉ tạo 1 muối:
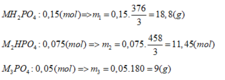
Ta thấy 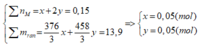
BTNT: P => nP = nMH2PO4 + nM2PO4 = 0,05 + 0,05 = 0,1 (mol)
=> nP2O5 = ½ nP = 0,05 (mol)
=> mP2O5 = 0,05. 142 = 7,1 (g)

104,48gam104,48gam
Giải thích các bước giải:
Sơ đồ phản ứng:
⎧⎪ ⎪ ⎪⎨⎪ ⎪ ⎪⎩AlMgFeOFe3O4+HNO3−−−−−→⎧⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎨⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎩NO,N2OH2O⎧⎪⎨⎪⎩Al(NO3)2Mg(NO3)2Fe(NO3)2to→⎧⎨⎩Al2O3MgOFe2O3+NO2+O2{AlMgFeOFe3O4→+HNO3{NO,N2OH2O{Al(NO3)2Mg(NO3)2Fe(NO3)2→to{Al2O3MgOFe2O3+NO2+O2
Oxi chiếm 20,22%20,22% khối lượng hỗn hợp.
mO=25,32%.25,32=5,12gammO=25,32%.25,32=5,12gam
→nO=0,32mol→nO=0,32mol
Gọi số mol của NONO và N2ON2O lần lượt là xx và yy mol
⎧⎨⎩x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02{x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02
Quy đổi hỗn hợp X thành các nguyên tố: Al,Mg,Fe,OAl,Mg,Fe,O
→mKl=25,32−5,12=20,2g→mKl=25,32−5,12=20,2g
→mO(cr)=30,92−20,2=10,72gam→mO(cr)=30,92−20,2=10,72gam
→nO=0,67mol→nO=0,67mol
3nAl+3nFe+2nMg=2nO(cr)3nAl+3nFe+2nMg=2nO(cr)
Gọi số mol của NH4NO3NH4NO3 là xx mol
Bảo toàn e:
3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O
0,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.80,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.8
→nNH4NO3=0,015mol→nNH4NO3=0,015mol
Khối lượng muối:
m=mKl+mNO−3+mNH4NO3m=mKl+mNO3−+mNH4NO3
=20,2+0,67.2.62+0,015.80=104,48gam

bảo toàn điện tích ta có: 0,1*2+0,1=x+y =0,3
lại có 30,9= 0,1*137+0,1*39+35,5*x+62*y
giải hệ x,y ta có : x=0,2; y=0,1

Phương trình phản ứng:
AlCl\(_3\)+3NaOH\(\rightarrow\)\(Al\left(OH\right)_3\downarrow\)+3NaCl
\(Al_2\left(SO_4\right)_3\)+6NaOH\(\rightarrow\)Al(OH)\(_3\)\(\downarrow\)+3Na\(_2\)SO\(_4\)
nAl(OH)\(_3\)= nAlCl\(_3\)= 0,1 (mol) (1)
mAl(OH)\(_3\) = 0,1*78 =7,8(g)
nAl(OH)\(_3\)=n2Al(OH)\(_3\)=0,09(mol) (2)
mAl(OH)\(_3\)=0,09*7,8=7,02(g)
m=7,02+7,8=14,82(g).
vì đầu bài chỉ hỏi m ở giai đoạn một nên tôi chỉ tính thế thôi.

Coi hỗn hợp bazo là 0,5 mol MOH với M = 32,6 g (Phương pháp trung bình)
mmuối khan = 35,4
TH1:\(\left\{{}\begin{matrix}MH_2PO_4:x\\M_2HPO_4:y\end{matrix}\right.\Rightarrow_{ }\left\{{}\begin{matrix}x+2y=0,5\\129,6x+161,2y=35,4\end{matrix}\right.\)
TH1:\(\left\{{}\begin{matrix}MH_3PO_4:y\\M_2HPO_4:x\end{matrix}\right.\Rightarrow_{ }\left\{{}\begin{matrix}2x+3y=0,5\\161,2x+192,8y=35,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
TH1:M3PO4 : 0,5⇒mmuoi=68,4 (L)
Đặt nP= x mol, nOH- =0,15 mol
TH1: Axit dư, x > 0,15
Dễ thấy chất rắn gồm
(x-0,15)/2 mol P2O5, 0,1 mol NaH2PO4, 0,05 mol KH2PO4
→mrắn= 142. (x-0,15)/2+ 99.0,1+ 136.0,05 > 8,56 gam (Vô lí)
TH2: Kiềm dư, x < 0,15/3= 0,05
Chất rắn gồm: x mol PO43-, 0,15-3x mol OH-, 0,1 mol Na+, 0,05 mol K+
→ mrắn= 95x+ 17. (0,15-3x)+ 23.0,1+ 39.0,05= 8,56 gam
→ x= 0,04
Vậy nP2O5= 0,02 mol→m= 2,84 gam
TH3: Tạo hỗn hợp muối, 0,05 < x< 0,15
Chất rắn gồm:
H2PO4-, HPO42-, PO43- (hai trong 3 gốc này): x mol; K+: 0,05 mol, Na+: 0,1 mol
→mrắn= M.x+ 23.0,1+ 39.0,05
Vì x> 0,05 và M> 95 nên mrắn > 95.0,05+ 2,3+1,95=9 >8,56
→Không thỏa mãn
Đáp án D