Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Có Fe -> Fe2+
Cu -> Cu2+
Vì dư H+ và NO3 - thì Fe2+ -> Fe3+
(nhưng dạng bài kiểu này thì chắc chắn cho dư H+ và NO3- nên cứ cho Fe lên thẳng luôn )
nH+ = 0.4 mol
nNO3- = 0.08 mol
Fe + 4H+ + NO3- -> Fe3+ + NO + 2H2O
0.02--0.08---0.02
3Cu + 8H+ + 2NO3- -> 3Cu2+ + NO + 4H2O
0.03---0.08----0.02
nH+ dư = 0.4 -0.16= 0.24 mol
nNaOH(tối thiểu) = nH+ (trung hòa H+) + 3nFe3+ + 2nCu2+
= 0.24 + 0.02 nhân 3+ 0.03 nhân 2 = 0.36 mol
V tối thiểu = 360ml
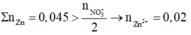
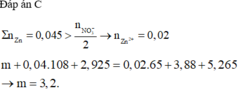

 với các chất sau:
với các chất sau:
n A g N O 3 = 0 , 2 . 0 , 2 = 0 , 04
Thông thường, khi đọc xong đề bài các bạn sẽ viết các phản ứng:
Cu + 2AgNO3⟶Cu(NO3 )2 + 2Ag
Zn + Cu(NO3)2 ⟶ Zn(NO3)2 + Cu
Zn + 2AgNO3 ⟶ Zn(NO3)2 +2Ag.
Tuy nhiên phản ứng giữa Cu và AgNO3 ta không thể biết được chất nào dư, chất nào hết, do đó nếu làm theo cách bình thường ta sẽ thử xét 2 trường hợp, nhưng khi cho Zn vào dung dịch Y thì thì ta cũng không biết được chất nào dư, chất nào hết.
Do đó nếu nhìn theo cách bình thường thì bài toán trở nên rất phức tạp.
Tuy nhiên đọc lại đề bài 1 lần nữa, ta thấy có một giả thiết quan trọng là “dung dịch chỉ chứa 1 muối duy nhất”, đây chính là nút thắt của bài toán.
Dễ thấy dung dịch sau phản ứng chỉ chứa muối Zn(NO3)2
⇒ Tất cả ion sẽ đi hết vào muối Zn(NO3)2.
Khi ta không biết rõ chất nào dư hay hết, phản ứng đã xảy ra hoàn toàn hay chưa thì chúng ta nên nghĩ đến định luật bảo toàn khối lượng:
Cộng vế theo vế 2 phương trình trên ta được:
Hay m = 3,88 + 0,02.189 + 5,265 - 0,04.170 - 2,925 = 3,2 gam.
Đáp án D.