Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = CM(MnCl2)CM(MnCl2) = CM(NaClO) =0,80,50,80,5 = 1,6 mol/l
CM(NaOH)dư = 2.1,60,52.1,60,5 = 0,8 mol/l

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.

A. Bất cứ phản ứng nào cũng chỉ vận dụng được một trong các yếu tố ảnh hưởng đến tóc độ phản ứng để tăng tốc độ phản ứng.
B. Bất cứ phản ứng nào cũng phải vận dụng đủ các yếu tố ảnh hưởng đến tốc độ phản ứng mới tăng được tốc độ phản ứng.
C. Tùy theo phản ứng mà vận dụng một, một số hay tất cả các yêu tố ảnh hưởng đến tốc độ phản ứng để tăng tốc độ phản ứng.
D. Bất cứ phản ứng nào cũng cần chất xúc tác để tăng tốc độ phản ứng.

Trong các phản ứng trên chỉ có phản ứng C là phản ứng oxi hoá – khử vì có sự thay đổi số oxi hoá của các nguyên tố.

Chọn đáp án D
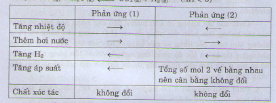
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (DH < 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
Đối với phản ứng thu nhiệt (DH > 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều thuận, khi giảm nhiệt độ cân bằng chuyển dịch sang chiều nghịch.
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí. ( nếu số mol khí 2 bên bằng nhau thì áp suất không ảnh hưởng đến chiều phản ứng)
Chú ý: chất xúc tác chỉ có tác dụng làm tăng tốc độ phản ứng chứ không làm thay đổi chiều phản ứng.
Vậy các biện pháp (2), (3), (5) sẽ làm cân bằng trên chuyển dịch theo chiều thuận.
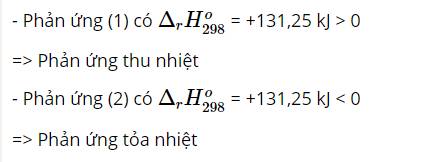
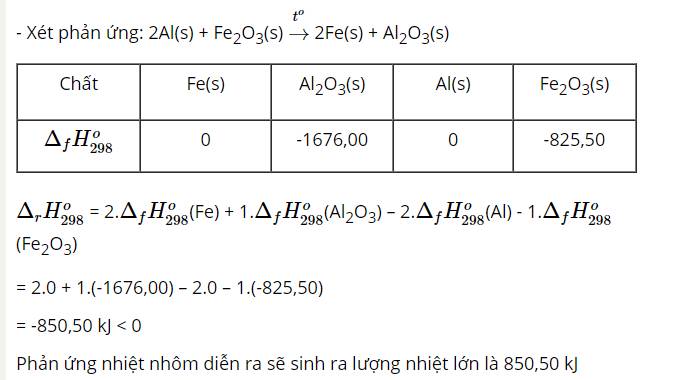
Chọn A
∆ H = - 198 , 24 k J < 0 → phản ứng thuận tỏa nhiệt.
Giảm nhiệt độ của phản ứng, cân bằng sẽ chuyển dịch theo chiều phản ứng tỏa nhiệt tức chiều thuận