Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì khi nung CaCO3, khí CO2 thoát ra nên khối lượng chất rắn thu được sau phản ứng giảm. Phương trình hóa học :
CaCO3 →t° CaO + CO2
Vì khi nugn thanh sắt thì sắt sẽ kết hợp với oxi tạo oxit sắt nên khối lượng tăng sau phản ứng.

a) Công thức về khối lượng phản ứng:
mCaCO3 = mCaO + mCO2
b) Áp dụng định luật bảo toàn khối lượng ta có :
mCaCO3 = 140 + 110 = 250 kg
Tỉ lệ phần trăm của Canxi cacbonat có trong đá vôi là :
%mCaCO3 = \(\frac{250.100\text{%}}{280}\) = 89,28%.

Mấy cái này bn lên mạng mà tìm, nó có hết á. Mấy câu bn đăg lên toàn là những câu có trên mạng. Sao ko tìm đi. ![]()
Tham khảo:
Vì khi nung CaCO3, khí CO2 thoát ra nên khối lượng chất rắn thu được sau phản ứng giảm. Phương trình hóa học :
CaCO3 →t° CaO + CO2
Vì khi nugn thanh sắt thì sắt sẽ kết hợp với oxi tạo oxit sắt nên khối lượng tăng sau phản ứng.

bài 1: N2+3H2-->3NH3
3Fe+2O2-->Fe3O4
CO2+Ca(OH)2-->CaCO3+H2O
3C+2Fe2O3-->4Fe+3CO2
3Ca+2H3PO4-->Ca3(PO4)2+3H2
Na+S--> Na2S
2Al+3Cl2-->2AlCl3
Fe3O4+4CO-->3Fe+4CO2
Fe+3Br2-->2FeBr3
2KClO3--->2KCl+3O2
2NaNO3-->2NaNO2+O2
Na2CO3+MgCl2-->MgCO3+2NaCl
2HNO3+Ca(OH)2-->Ca(NO3)2+2H2O
2H3PO4+3Ca(OH)2-->Ca3(PO4)2+6H2O

\(PTHH:CaCO_3\rightarrow CaO+CO_2\)
- 100g/mol 56g/mol
- 50g ?
\(m_{CaO}=\frac{59.56}{100}=28\left(g\right)\)
\(m_{CaO_{tt}}=\frac{28.90\%}{100\%}=25,5\left(g\right)\)

+) Khối lượng bằng gam của 1 phân tử nước là:
\(0,16605\times10^{-23}\times18=2,9889\times10^{-23}\left(g\right)\)
Khối lượng bằng gam của \(6,02\times10^{23}\) phân tử nước là:
\(6,02\times10^{23}\times2,9889\times10^{-23}=17,993178\left(g\right)\)
+) Khối lượng bằng gam của 1 phân tử CO2 là:
\(0,16605\times10^{-23}\times44=7,3062\times10^{-23}\left(g\right)\)
Khối lượng bằng gam của \(6,02\times10^{23}\) phân tử CO2 là:
\(6,02\times10^{23}\times7,3062\times10^{-23}=43,983324\left(g\right)\)
+) Khối lượng bằng gam của 1 phân tử CaCO3 là:
\(0,16605\times10^{-23}\times100=16,605\times10^{-23}\left(g\right)\)
Khối lượng bằng gam của \(6,02\times10^{23}\) phân tử CaCO3 là:
\(6,02\times10^{23}\times16,605\times10^{-23}=99,9621\left(g\right)\)
m\(H_2O\) = n.M = \(\frac{6,02.10^{23}}{6.10^{23}}.18\) = 18,06 g
m\(CO_2\) = n.M = \(\frac{6,02.10^{23}}{6.10^{23}}.44\) = 44,14(6) g
m\(CaCO_3\) = n.M = \(\frac{6,02.10^{23}}{6.10^{23}}.100\) = 100,(3) g

a/ 4P + 5O2 -----> 2P2O5
b/ 4H2 + Fe3O4 -----> 3Fe + 4H2O
c/ 3Ca + 2H3PO4 ------> Ca3(PO4)2 + 3H2
a) 4P + 5O2 ----> 2P2O5
- Hiện tượng :Photpho cháy mạnh trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong nước. Bột trắng đó là điphotpho pentaoxit và có công thức hoá học là P2O5
-Điều kiện: dư oxi
b) Fe3O4 +4H2 ---> 3Fe + 4H2O
-Hiện tượng :Fe3O4 màu nâu đen chuyển sang màu trắng xám của Fe,xuất hiện hơi nước trên thành ống nghiệm.
- Điều kiện: >570 độ C
c) 3Ca + 2H3PO4 ---> Ca3(PO4)2 +3H2
-Hiện tượng : Ca tan dần trong dung dịch,có khí không màu thoát ra là H2
-Điều kiện : nhiệt độ phòng
Chúc em học tốt !!

Bài 1:
Axit sunfuric: H2SO4
Axit sunfuro: H2SO3
Natri hidrocacbonat: NaHCO3
Natri hidroxit: NaOH
Sắt (III) clorua: FeCl3
Sắt (II) oxit: FeO
Natri silicat: Na2SiO3
Canxi cacbonat: CaCO3
Canxi hidrophotphat: CaHPO4
Canxi hidrosunfat: Ca(HSO4)2
Natri Aluminat: NaAlO2
Bài 2:
1) 4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
2) 2Ca + O2 → 2CaO
CaO + H2O → Ca(OH)2
3) S + O2 \(\underrightarrow{to}\) SO2
2SO2 + O2 \(\underrightarrow{to}\) 2SO3
SO3 + H2O → H2SO4
H2SO4 + Zn → ZnSO4 + H2↑
Bài 1
Viết CTHH của những chất có tên sau :
Axit Sunfuric: H2SO4
Axit sunfuro: H2SO3
Natri hidrocacbonat: NaHCO3
Natri hidoxit: NaOH
Sắt (III) clorua: FeCl3
Sắt (II) oxit: FeO
Natri silicat: Na2SiO3
Canxi cacbonat : CaCO3
Canxi hidrophotphat: CaHPO4
Canxi hidrosunfat: Ca(HSO4)2
Natri ALuminat: NaAlO2

a.Fe2O3+3H2SO4----->Fe2(SO4)3+3H2O
b.Fe3O4+4H2SO4----->Fe2(SO4)3+FeSO4+4H2O
c.2Al(OH)3+3H2SO4----->Al2(SO4)3+6H2O
d.Fe(OH)2+H3PO4----->FeHPO4+2H2O
đ.KOH+H3PO4----->KH2PO4+H2O
e.2Fe(OH)2+O2+H2O----->2Fe(OH)3

Tham khảo :
PTHH :
Fe3O4 + 4CO -----> 3Fe + 4CO2
Fe3O4 + 4H2 -----> 3Fe + 4H2O
Phản ứng đủ
Theo Định luật BTKL ta có :
mFe3O4 + mhh (khí) - mCO2 - mH2O = mFe
=> 139,2 + 36 - 74,4 = mFe
=> 100,8 (g) = mFe
Vậy khối lượng sắt thu được sau phản ứng là 100,8 (g)
Tham khảo:
m_Fe=m=139,2+36-74,4=100,8 gam
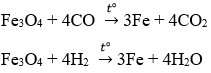
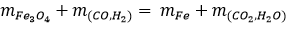
\(CaCO_3\rightarrow\left(t^o\right)CaO+CO_2\\ n_{CaCO_3}=\dfrac{200}{100}=2\left(mol\right)\\ n_{CaO}=\dfrac{100,8}{56}=1,8\left(mol\right)\\ V\text{ì}:\dfrac{2}{1}>\dfrac{1,8}{1}\Rightarrow CaCO_3d\text{ư}\\ n_{CaCO_3\left(p.\text{ứ}\right)}=n_{CaO}=1,8\left(mol\right)\\ m_{CaCO_3\left(d\text{ư}\right)}=200-1,8.100=20\left(g\right)\)