Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Từ phản ứng hidro hóa → X có tổng cộng 2π → Không thể là HCHO.
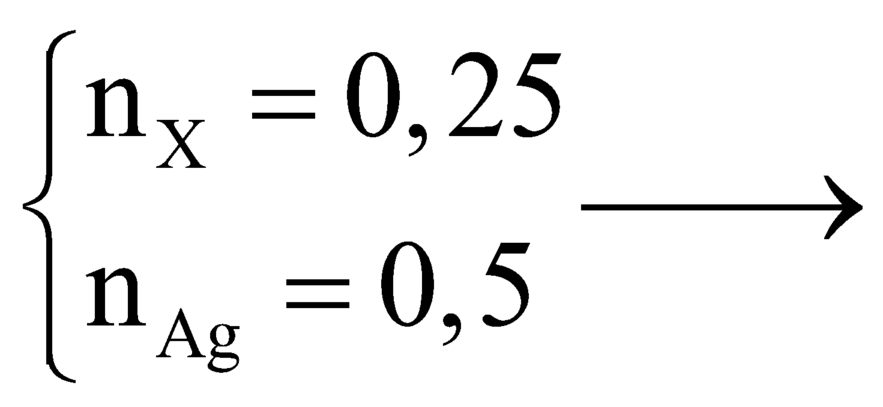 X là đơn chức và có 1 liên kết đôi C=C.
X là đơn chức và có 1 liên kết đôi C=C.

Ta có nAg = 0,5 mol = 2nanđehit =>Andehit đơn chức => Loại D
Vì nH2 = 2nandehit => Andehit có 2 liên kết π
=> Ngoài một liên kết trong nhóm -CHO còn có 1 liên kết π trong liên kết nối C = C
Vậy andehit có dạng CnH2n-1CHO (n ≥ 2) => Chọn B

Đáp án B
nAg : nX = 2 => X có 1 nhóm -CHO
nH2 : nX = 2 => X có 2 nối đôi
=> X là andehit không no, đơn chức, có 1 nối đôi C=C
=> X là C n H 2 n - 1 CHO n ≥ 2

Đáp án : B
nAg : nX = 2 => X có 1 nhóm -CHO
nH2 : nX = 2 => X có 2 nối đôi
=> X là andehit không no, đơn chức, có 1 nối đôi C=C
=> X là CnH2n-1CHO (n ≥ 2)

Đáp án B
Hướng dẫn n H 2 n X = 0 , 25 0 , 125 = 2 → Trong phân tử X có 2 liên kết π
n A g = 0 , 5 m o l → n A g n X = 0 , 5 0 , 25 = 2 → anđehit đơn chức
→ A là anđehit không no, đơn chức , 1 liên kết C = C → Công thức chung là C n H 2 n − 1 C H O ( n ≥ 2 ) .

Ta có nAg = 2,7/108 = 0,025 mol
Do nAg = 2nanđehit =>X đơn chức => Loại A.
Mà nH2 = 2nX => X có 2 liên kết π =>Ngoài 1 liên kết π trong nhóm chức –CHO thì X còn có 1 liên kết π trong gốc hiđrocacbon => Dãy đồng đẳng của X có dạng CnH2n-1CHO (n≥ 2) => Chọn C

Đáp án D
![]() là anđehit đơn chức
là anđehit đơn chức
![]() X là anđehit không no, có 1 liên kết đôi C=C
X là anđehit không no, có 1 liên kết đôi C=C
Do đó dãy đồng đẳng của X là: ![]()
Chọn D

+ 1/2 X + NaOH dư:
\(n_{BaCO_3}=\dfrac{9,85}{197}=0,05mol\)
\(Ba^{2+}+HCO_3^-+OH^-\rightarrow BaCO_3\downarrow+H_2O\)
................0,05<-----------------0,05
\(\Rightarrow n_{HCO_3^-}=2.0,05=0,1mol\)
+ 1/2 X + NaHSO4 dư:
\(n_{BaSO_4}=\dfrac{17,475}{233}=0,075mol\)
\(HSO_4^-+HCO_3^-\rightarrow SO_4^{2-}+CO_2\uparrow+H_2O\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
\(Ba^{2+}+HSO_4^-\rightarrow BaSO_4\downarrow+H^+\) (nếu có)
\(\Rightarrow n_{Ba^{2+}}=2.0,075=0,15mol\)
Áp dụng định luật bảo toàn điện tích vào dung dịch X:
\(n_{HCO_3^-}+n_{Cl^-}=2n_{Ba^{2+}}+n_{Na^+}\)
\(\Rightarrow0,1+0,3=2.0,15+n_{Na^+}\Rightarrow n_{Na^+}=0,1mol\)
+ Đun nóng X:
\(2HCO_3^-\rightarrow^{t^0}CO_3^{2-}+CO_2\uparrow+H_2O\)
0,1------------>0,05
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
0,05<---0,05------->0,05
\(n_{Ba^{2+}}\text{còn}=0,15-0,05=0,1mol\)
=> Dung dịch X có chứa: 0,1 mol Ba2+; 0,1 Na+; 0,3 mol Cl-
\(\Rightarrow m_{\text{muối}}=137.0,1+23.0,1+35,5.0,3=26,65\left(gam\right)\)
Chọn C