Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
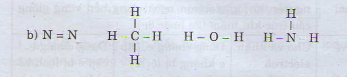
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g

Cl2+H2O --->(mũi tên 2 chiều)HCl+HClO
Na2CO3+HCl------>NaCl+CO2+H2O

\(Br_2+2KOH\rightarrow KBr+KBrO+H_2O\)
\(3Br_2+6KOH\rightarrow5KBr+KBrO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
\(Br_2+2KI\rightarrow2KBr+I_2\)
\(Cl_2+2NaOH\rightarrow KBr+KBrO+H_2O\)
\(3Cl_2+6KOH\rightarrow5KCl+KClO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Cl_2+2KBr\rightarrow2KCl+Br_2\)
Tương tự cho NaBr, NaI, KI, MgBr2, CaBr2, BaBr2
\(I_2+2KOH\rightarrow KI+KIO+H_2O\)
\(3I_2+6KOH\rightarrow5KI+KIO_3+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
I2 + NaOH ở điều kiện thường hay nhiệt độ thì sản phẩm luôn là muối IO3- nha em

Gọi chung Cl2 và Br2 là X2, 2 bazo là ROH
X2 + 3ROH → 2RX + RXO3 + 3H2O
X2 + 2ROH→ RX + RXO + H2O
nROH = 0.5 mol
nX2 = 0.25 mol
→ Phản ứng xảy ra là phản ứng 2 (nROH = 2nX2)
Cl2 phản ứng trước Br2
X2 + 2ROH→ RX + RXO + H2O
→ Cl2 + 2ROH → NaCl + NaClO + H2O
----0.1-----0.2--------0.1
mH2O = 0.1 x 18 = 1.8g
nROH = 0,5 → mROH = 24.8g (0.2 NaOH, 0.3 KOH)
→ nROH = 0,2 → mROH = 9.92g
[m] mRCl = mCl2 + mROH p/ứ - mH2O
= 7.1 + 9.92 - 1.8 = 15,22.
1.
nCl2 = \(\frac{0,896}{22,4}\) = 0,04 (mol) , nNaOH = 1.0,2 = 0,2 (mol)
............Cl2 + 2NaOH → NaCl + NaClO + H2
Đầu.. 0,04........0,2
Pư .......0,04.......0,08............0,04.........0,04.........0,04
Spư......0............0,16............0,04.........0,04.........0,04
CM NaCl = \(\frac{0,04}{0,2}=0,2M\)
CM NaClO = CM NaCl = 0,2 M
CM NaOH = \(\frac{0,12}{0,2}=0,6M\)


Các quá trình xảy ra ở các điện cực khi điện phân dung dịch NaCl:
Anot (+): 2Cl-1 -2e → Cl2 || Catot (-) 2H2O + 2e → 2OH- + H2.
→ Ở cực dương xảy ra sự oxi hóa ion Cl-, cực âm xảy ra sự khử H2O.