Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ba thí dụ phản ứng phân hủy là phản ứng oxi hoá – khử :
CaCO3 -tº\(\rightarrow\) CaO + CO2\(\uparrow\)
NH4Cl -tº\(\rightarrow\) NH3 + HCl
Cu(OH)2 -tº\(\rightarrow\) CuO + H2O
Ba thí dụ phản ứng phân hủy không là phản ứng oxi hoá – khử
Cu(OH)2 -tº\(\rightarrow\)CuO + H2O
СаСОз -tº\(\rightarrow\) CaO + CO2
H2CO3 -tº\(\rightarrow\) CO2 + H2O.

Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng.
Thí dụ:
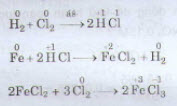
: Phản ứng oxi hoá – khử là phản ứng hoá học trong đó có xảy ra đồng thời sự oxi hoá và sự khử.
Ví dụ: Fe2O3 + 3H2 −to→ 2Fe + 3H2O
CuO + H2 −to→ Cu + H2O

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.

Sỡ dĩ phản ứng thế luôn luôn là loại phản ứng oxi hóa – khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hóa của các nguyên tố.

a) (1) 2КСЮ3 \(\rightarrow\) 2KCl + 3O2 ; (2) S + O2 —> SO2
(3) SO2 + 2NaOH \(\rightarrow\) Na2SO3 + H2O
Phản ứng oxi hoá – khử là (1) và (2).
b) (1) S + H2 \(\rightarrow\) H2S ; (2) 2H2S + 3O2 \(\rightarrow\)2SO2 + 2H2O
(3) 2SO2 + O2 \(\rightarrow\) 2SO3 ; (4) SO3 + H2O \(\rightarrow\) H2SO4
Phản ứng oxi hoá – khử là : (1); (2); (3).
.jpg)
Sở dĩ phản ứng thế luôn luôn là loại phản ứng oxi hoá – khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
phản ứng thế luôn luôn là loại phản ứng oxi hoá - khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi sô' oxi hoá của các nguyên tố.