Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo!
-Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do
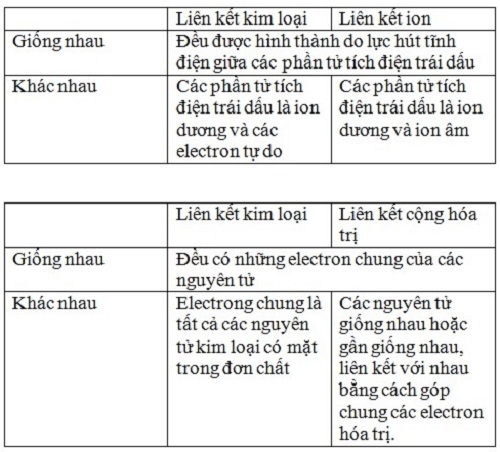
So sánh liên kết kim loại với liên kết cộng hóa trị:- Giống nhau: có sự dùng chung electron.
- Khác nhau:
+ Liên kết cộng hóa trị: sự dùng chung electron giũa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: sự dùng chung electron toàn bộ electron trong nguyên tử kim loại.
So sánh liên kết kim loại với liên kết ion.- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.

Liên kết kim loại là liên kết sinh ra bởi lực hút tĩnh điện giữa các electron tự do và các ion dương, kết dính các ion dương kim loại với nhau.
So sánh liên kết kim loại với liên kết cộng hóa trị:
- Giống nhau: có sự dùng chung electron.
- Khác nhau:
+ Liên kết cộng hóa trị: sự dùng chung electron giũa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: sự dùng chung electron toàn bộ electron trong nguyên tử kim loại.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.

Các tính chất hóa học của kim loại là
1. Tác dụng với phi kim
-Tác dụng với clo: 2Fe+3Cl2----->2FeCl3
-Tác dụng với oxi: 4Al+3O2------>2Al2O3
-Tác dụng với lưu huỳnh: Fe+S----->FeS
2. Tác dụng với dung dịch axit
-dung dịch HCl, H2SO4 loãng: Fe+ 2HCl------>FeCl2+H2
-dung dịch HNO3,H2SO4 đặc: 3Cu+8 HNO3-->3Cu(NO3)2+2NO+4H2O
3.Tác dụng với nước:
2Na+2H2O------>2NaOH+H2
4. Tác dụng với dung dịch muối
Fe+CuSO4-------->FeSO4+Cu

Khi hòa tan X vào nước ta có phản ứng:
K + H2O --> KOH + (1/2)H2 ↑ (1)
Al + KOH + H2O --> KAlO2 + (3/2)H2 ↑ (2)
x ---- x
- - -
dung dịch A thu được gồm KAlO2 và KOH còn dư
khi cho HCl vào A, thì phản ứng trung hòa xãy ra trước, các pứ như sau:
HCl + KOH --> KCl + H2O (3)
HCl + KAlO2 + H2O --> KCl + Al(OH)3 ↓ (4)
3HCl + Al(OH)3 --> AlCl3 + 3H2O (5)
theo đề bài phản ứng (1) xãy ra xong, vừa bắt đầu có ↓ nên HCl vừa đủ cho pứ (3)
=> số mol HCl cho pứ (3) là 0,1*1 = 0,1 mol = mol KOH trong A
Gọi x là số mol Al => mol KOH (pư2) = x
=> mol KOH tạo thành từ (1) = x + 0,1
(ta hiểu KOH tạo ra từ (1), một phần cho pứ với Al ở (2), phần còn lại pứ với HCl)
từ (1) => mol K = x + 0,1
ta có: mX = 27x + 39(x+0,1) = 10,5 => x = 0,1
=> mAl = 27*0,1 = 2,7
%Al = 2,7*100 /10,5 = 25,71 %
% K = 74,29 %

Chọn đáp án B
(1) Đúng. Điện tích tăng dần → sức hút giữa lớp vỏ và hạt nhân tăng → bán kính giảm dần.
(2) Sai. Tính kim loại tăng dần → độ âm điện giảm dần.
(3) Đúng. Liên kết giữa kim loại mạnh và phi kim mạnh luôn có hiệu độ âm điện > 1,7.
(4) Sai. Nguyên tử N trong HNO3 cộng hoá trị là 4 (là hoá trị cao nhất của nitơ)
(5) Đúng.

- Cấu tạo của nguyên tử kim loại.
+ Có số electron hóa trị ít.
+ Trong cùng một chu kì các nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tố phi kim trong cùng chu kì.
- Cấu tạo tinh thể kim loại.
+ Kim loại có cấu tạo tinh thể, tinh thể kim loại có cấu tạo mạng.
+ Có 3 loại kiểu mạng tinh thể phổ biến là : Mạng tinh thể luc phương , mạng tinh thể lập phương tâm diện , mạng tinh thể lập phương tâm khối.

-Nguyên tử của hầu hết nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1,2 hoặc 3e). Thí dụ
Na: [Ne]3s1
Mg: [Ne]3s2
-Cấu tạo tinh thể : Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, các kim loại khác ở thể rắn và có cấu trúc tinh thể
Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút của mạng tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.

-Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do
-