Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

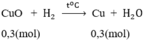
CuO + H2 \(-^{t^o}\rightarrow\) Cu + H2O (1)
3Cu + 8HNO3 \(\rightarrow\) 3Cu(NO3)2 + 2NO + 4H2O (2)
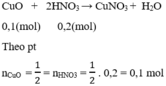
CuO + 2HNO3 \(\rightarrow\) Cu(NO3)2 + 2NO + 4H2O (3)
Ta có : nNO = 0,2 mol.
Theo (2) :\( n_{Cu}=\frac{3}{2}n_{NO}=0,3\) mol ; \(n_{HNO_{3}}=\frac{8}{3}n_{NO}=0,8 (mol).\)
Theo (3) : \(n_{CuO}=\frac{1}{2}n_{HNO_{3}}=\frac{1}{2}(1-0,8)=0,1(mol).\)
=> nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là :\( H = \frac{0,3}{0,4}.100=75%.\)
=> Chọn B.

Đáp án B
Số mol HNO3: nHNO3 = 1. 1 = 1(mol)
Số mol NO: 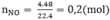
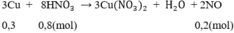
Theo pt: nHNO3 = 4. nNO = 4. 0,2 = 0,8 mol
nHNO3 còn lại = 1 – 0,8 = 0,2 (mol)
⇒ CuO dư phản ứng với HNO3
⇒ Tổng nCuO = 0,1 + 0,3 = 0,4 mol
Ban đầu 0,4 mol CuO, phản ứng 0,3 mol CuO
Hiệu suất 

Bạn xem câu trả lời của mk nha :
CuO + H2 -> Cu + H2O (1)
3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 -> Cu(NO3)2 + 2NO + 4H2O (3)
Ta có : nNO = 0,2 mol.
Theo (2) : mol ;
(mol).
Theo (3) : (mol).
=> nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là : 75%.
Đáp án là B.

Phản ứng nhiệt nhôm không hoàn toàn nên ta không thể xác định được rõ sản phẩm Y gồm những chất nào. Ta quy đổi hỗn hợp Y thành X ( theo nguyên BTKL )
=> m = 0,02( 27 + 160) = 3,74 gam
Để đơn giản ta coi hỗn hợp X tác dụng với HNO3 loãng dư:
Các bán phản ứng Oxi hóa - khử:
\(Al\rightarrow Al^{3+}+3e\)
x--------------->3x
\(N^{+5}+3e\rightarrow N^{+2}\)
...........0,06<--0,02
\(\Rightarrow3x=0,06\Rightarrow x=0,02mol\)
\(m=m_{Al}+m_{Fe_2O_3}=27.0,02+160.0,02=3,74\) gam

Ta có lượng Oxi trong CuO sẽ đi vào CO2 và H2O
Gọi x,y lần lượt là số mol CH 3OH và C2H5OH
Phản ứng:
CH3OH + 3CuO → CO2 + 2H2O + 3Cu
x(mol) 3x(mol) x mol 2x mol 3x mol
C2H5OH + 6CuO → 2CO2 + 3H2O + 6Cu
6y mol 2y mol 3y mol
Số mol Oxi dùng là: 3x + 6y = 160: 16 = 10 mol
Số mol H2O được sinh ra: 2x + 3y = 108 : 18 = 6 mol
Giải ra ta được x = 2 mol, y = 2/ 3 mol
Khối lượng etanol là 46. (2: 3) = 30,666 gam

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Phần II : BTNT N : nNO3- ( muoi ) = nHNO3 p/u – nNO = 0,875.0,8 – 1,568/22,4 = 0,63 mol
Fe àFe(NO3)3 à 3NO3-
0,21 0,63
Phần I : BTNT Fe : nFe = nFeCl2 + nFeCl3
=> nFeCl2 = 0,21 – 13/162,5 = 0,13 mol
=> a = 0,13.127 = 16,51 gam

Khí X là CO2
Áp dụng định luật bảo toàn khối lượng: 14,2 = 7,6 + mx => mx = 6,6 gam =>nx = 0,15 mol
Vì nKOH : nCO2 = 0,1: 0,15 <1 => muối thu được là KHCO3
CO2 + KOH = KHCO3
Vậy m KHCO3 = 0,1.100 = 10 gam.

a) 2Cu + O2 -> 2CuO (1)
3CuO + 8HNO3 -> 3Cu(NO3)2 + 2NO + H2O (2)
CuO + 2HNO3 -> Cu(NO3)2 + 2H2O (3)
b)
nCu = 0,2 (mol) ; nNO = 0,02 (mol)
Từ (2) => nCu(dư) = nNO = 0,03 (mol) ;
(mol).
Từ (1) => nCuO = nCu(phản ứng) = 0,2 - 0,03 = 0,17 (mol).
Từ (3) => (mol).
Vậy thể tích dung dịch HNO3 cần dùng là : (lít).
CuO + H2 -> Cu + H2O (1)
3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 -> Cu(NO3)2 + 2NO + 4H2O (3)
Ta có : nNO = 0,2 mol.
Theo (2) : mol ;
mol ;  (mol).
(mol).
Theo (3) :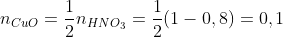 (mol).
(mol).
=> nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là :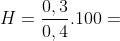 75%.
75%.
Đáp án B.