Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHgO = 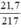 = 0,1 mol.
= 0,1 mol.
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.

a. Số mol thủy ngân (II) oxit là: n = \(\frac{m}{M}\) = \(\frac{21,7}{217}\) = 0,1 (mol)
phương trình phản ứng:
HgO + H2 → H2O + Hg
1 mol 1 mol 1mol 1 mol
0,1 0,1 0,1 0,1
Khối lượng thủy ngân thu được: m = 0,1.201 = 20,1 (g)
b. Số mol khí hi đro: n = 0,1 mol
Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.0,1 = 2,24 (lít)
a/ PTHH: HgO + H2 ===> Hg + H2O
nHgO = 21,7 / 217 = 0,1 mol
=> nHg = nHgO = 0,1 mol
=> mHg = 0,1 x 201 = 20,1 gam
b/ Theo phương trình, ta có:
nH2 = nHgO = 0,1 mol
=> VO2(đktc) = 0,1 x 22,4 = 2,24 lít

a) Fe2O3 + 3H2 \(\rightarrow\)2Fe + 3H2O; Hg
b) HgO + H2 \(\rightarrow\) + H2O;
c) PbO + H2 \(\rightarrow\) H2O + Pb
Phương trình phản ứng:
Fe3O4 + 4H2 → 4H2O + Fe
HgO + H2 → H2O + Hg
PbO + H2 → H2O + Pb

\(n_{HgO}=\dfrac{43,4}{217}=0,2\left(mol\right)\)
PTHH: HgO + H2 --to--> Hg + H2O
0,2 0,2 0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Hg}=201.0,2=40,2\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
nHgO = 43,4 : 217 = 0,2 (mol)
pthh : HgO + H2 -t> Hg + H2O
0,2 0,2 0,2
mHg = 0,2 . 201 = 40,2 (G)
VH2 = 0,2 . 22,4 = 4,48 (L)

nCuO = 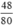 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

Bài 10: nH2= 0,125 mol
2H2 + O2 → 2H2O
0,125 mol 0,0625 mol 0,125 mol
a) VO2= 0,0625 x 22,4= 1,4 (l) ; mO2= 0,0625 x 32= 2 (g)
b) mH2O= 0,125 x 18 = 2,25 (g)
Bài 11: nH2= 22,4/22,4 = 1 mol; nO2= 16,8/22,4 =0,75 mol
2H2 + O2 → 2H2O
Ban đầu: 1 mol 0,75 mol
PƯ: 1 mol 0,5 mol 1 mol
Còn lại: 0 mol 0,25 mol 1 mol
mH2O= 1 x 18= 18 (g)

10) lập pthh của pư
2H2 + O2 → 2H20
2mol 1mol 2mol
0,125mol 0,0625mol 0,125mol
số mol của H2
nH2= 2,8 : 22,4 =0,125mol
thể tích khí H2
vH2= 0,0624 .22,4 =1,4 lít
khối lượng khí o2
mO2 = 0,0625 . 32= 2 gam
b) khối lượng H20 thu được
mH2O =0,125 . 18 = 2,25 gam
11) số mol h2
nH2= 22,4 : 2,24 = 10 mol
soosmol của O2
nO2= 16,8 : 22,4 = 0,75 mol
lập pthh của pư
2H2 + 02 → 2 H20
2mol 1mol 2mol
10mol 0,75mol 1,5mol
xét tỉ lệ
\(\frac{nH2}{2}\) = \(\frac{10}{2}\) = 5 > \(\frac{nO2}{1}\)= \(\frac{0,75}{1}\)= 0,75
vậy H2 dư sau pư tính theo O2
số mol H2 dư = ( 0.75 .2) : 1= 1,5 mol
số mol H2 dư = 5 - 1,5=3,5mol
khối lượng H2 dư
m= 3,5 .2=7 gam
khối lượng nước thu được
m=1,5 .2 =3gam

Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: = 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài giải:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: = 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g

\(HgO\left(0,1\right)+H_2\left(0,1\right)\rightarrow Hg\left(0,1\right)+H_2O\)
Ta có: \(n_{HgO}=\dfrac{21,7}{217}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Hg}=0,1.201=20,1\left(g\right)\\m_{H_2}=0,1.2=0,2\left(g\right)\end{matrix}\right.\)
a. Số mol thủy ngân (II) oxit là: n =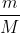 =
=  = 0,1 (mol)
= 0,1 (mol)
phương trình phản ứng:
HgO + H2 → H2O + Hg
1 mol 1 mol 1mol 1 mol
0,1 0,1 0,1 0,1
Khối lượng thủy ngân thu được: m = 0,1.201 = 20,1 (g)
b. Số mol khí hi đro: n = 0,1 mol
Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.0,1 = 2,24 (lít)