Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g

CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g

a)
- Gọi x, y lần lượt là số mol của \(CuO,ZnO\)
PTHH.
\(CuO+2HCl\rightarrow CuCl_2+H_2O\left(1\right)\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\left(2\right)\)
- Ta có hệ phương trình sau:
\(80x+81y=24,2\)
\(2x+2y=0,6\)
Giải hệ pt ta được: \(x=0,1\left(mol\right);y=0,2\left(mol\right)\)
\(\%m_{CuO}=\left(80.0,1:24,2\right).100\%=33,05\%\)
\(\%m_{ZnO}=100\%-33,05\%=66,95\%\)
200 ml =0,2 l
\(n_{HCl}=0,2.3=0,6\left(mol\right)\)
\(CuO+2HCl->CuCl_2+H_2O\left(1\right)\)
a 2a (mol)
\(ZnO+2HCl->ZnCl_2+H_2O\left(2\right)\)
b 2b (mol)
ta có
\(\begin{cases}80a+81b=24,2\\2a+2b=0,6\end{cases}\)
giả ra ta được a =0,1 (mol)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
thành phần % theo khối lượng mỗi oxit trong hỗn hợp ban đầu là
%CuO = \(\frac{8}{24,2}.100\%=33,06\%\)
%ZnO= 100% - 33,06% = 66,94%

Đổi 300ml = 0,3 lít
Ta có: \(n_{HCl}=2.0,3=0,6\left(mol\right)\)
a. PTHH:
CuO + 2HCl ---> CuCl2 + H2O (1)
ZnO + 2HCl ---> ZnCl2 + H2O (2)
b. Gọi x, y lần lượt là số mol của CuO và ZnO
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{ZnO}=2y\left(mol\right)\)
=> 2x + 2y = 0,6 (*)
Theo đề, ta có: 80x + 81y = 24,2 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+2y=0,6\\80x+81y=24,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
=> \(\%_{m_{CuO}}=\dfrac{8}{24,2}.100\%=33,06\%\)
\(\%_{m_{Zn}}=100\%-33,06\%=66,94\%\)
c. PTHH:
CuO + H2SO4 ---> CuSO4 + H2O (3)
ZnO + H2SO4 ---> ZnSO4 + H2O (4)
Theo PT(3): \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
Theo PT(4): \(n_{H_2SO_4}=n_{ZnO}=0,2\left(mol\right)\)
=> \(n_{H_2SO_4}=0,1+0,2=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

200 ml =0,2 l
nHCl=0,2.3=0,6(mol)
CuO+2HCl−>CuCl2+H2O(1)
a 2a (mol)
ZnO+2HCl−>ZnCl2+H2O(2)
b 2b (mol)
ta có
{80a+81b=24,2
2a+2b=0,6{
giả ra ta được a =0,1 (mol)
=> mCuO=0,1.80=8(g)
thành phần % theo khối lượng mỗi oxit trong hỗn hợp ban đầu là
%CuO = 824,2.100%=33,06%
%ZnO= 100% - 33,06% = 66,94%

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$ZnO + H_2SO_4 \to ZnSO_4 +H_2O$
b) Gọi $n_{CuO} = a(mol) ; n_{ZnO} = b(mol) \Rightarrow 80a +81b = 12,1(1)$
Theo PTHH :
$n_{H_2SO_4} = a + b = \dfrac{73,5.20\%}{98} = 0,15(mol)(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,1
$\%m_{CuO} = \dfrac{0,05.80}{12,1}.100\% = 33,06\%$
$\%m_{ZnO} = 100\% - 33,06\% = 66,94\%$

CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g

PTHH:
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
Đặt \(\hept{\begin{cases}x\left(mol\right)=n_{MgO}\\y\left(mol\right)=n_{Al_2O_3}\end{cases}}\)
\(\rightarrow n_{MgCl_2}=x\) và \(n_{AlCl_3}=2y\)
\(\rightarrow\hept{\begin{cases}40x+102y=12,2\\95x+133,5.2y=31,45\end{cases}}\)
\(\rightarrow\hept{\begin{cases}x=0,05mol\\y=0,1mol\end{cases}}\)
Theo phương trình: \(n_{HCl}=n_{NaOH}=0,02.2=0,04mol\)
\(\rightarrow\text{Σ}n_{HCl}=2x+6y+0,04=0,1+0,6+0,04=0,74mol\)
\(\rightarrow m_{HCl\left(bđ\right)}=0,74.36,5=27,01g\)
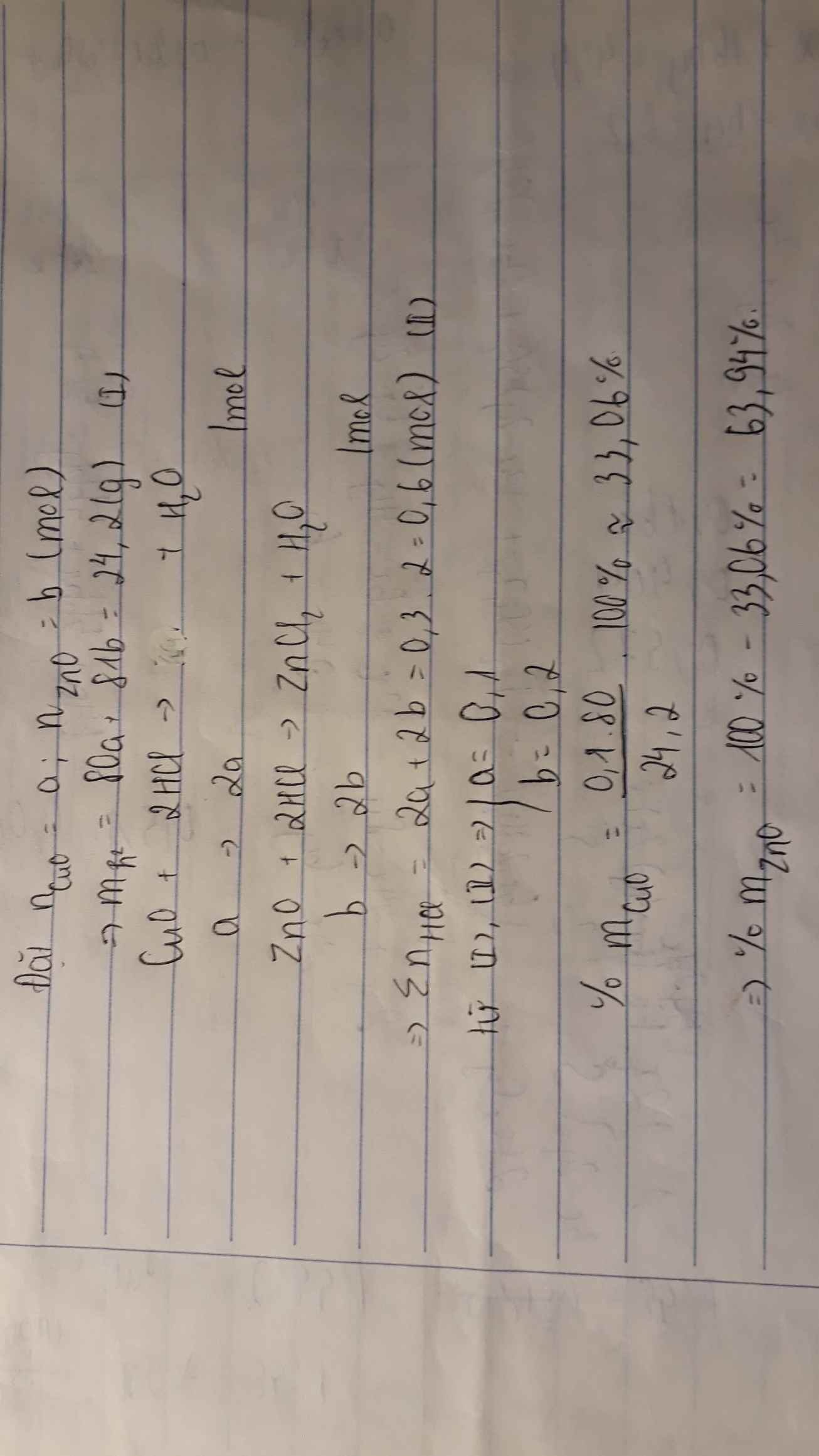
Số mol HCl = 3 . \(\dfrac{100}{1000}\) = 0,3 mol
Gọi x, y là số mol của CuO và ZnO
a) Các phương trinh hóa học:
CuO + 2HCl → CuCl2 + H2O
Phản ứng x 2x x (mol)
ZnO + 2HCl → ZnCl2 + H2O
Phản ứng: y 2y y (mol)
b) Từ khối lượng của hỗn hợp và số mol HCl, ta lập hệ phương trình.
\(\left\{{}\begin{matrix}80x+81y=12,1\\2x+2y=0,3\end{matrix}\right.\)
Giải (1)(2) ta được x = 0,05 mol = số mol CuO; y = 0,1 mol = số mol ZnO
%CuO = \(\dfrac{m_{CuO}}{m_{hh}}\) . 100% = \(\dfrac{0,05\times80\times100}{12,1}\) = 33%
c) Vì CuO và ZnO phản ứng với H2SO4 theo cùng tỉ lệ mol, nên có thể coi hai oxit như một oxit có công thức chung là MO với số mol = x + y = 0,15 mol
MO + H2SO4 → MSO4 + H2O
Phản ứng: 0,15 0,15 0,15 (mol)
m H2SO4 = 0,15 . 98 = 14,7 g
m dd H2SO4 20% = \(\dfrac{14,7\times100}{20}\) = 73,5 g
bạn ơi hỗn hợp CuO và ZnO là 12,2g chứ ko phải 12,1g đâu bạn