Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)NaOH+SO2 \(\rightarrow\) NaHSO3 (1)
NaOH+SO2 \(\rightarrow\) Na2SO3+H2O (2)
b)Ta có co số mol SO2 là : n = 12,8 / 64 = 0,2
số mol NAOH là : n =0,25 x 1 = 0,25
Ta có tỷ lệ :
n [NaOH]/ n [SO2] = 0,25/0,2 = 1,25
Nên sẽ xảy ra đồng thời 2 phản ứng 1 và 2
NaOH + SO2 = NaHSO3 (1)
x mol x mol x mol
2NaOH + SO2 = Na2So3 + H2O (2)
y mol y/2 mol y/2 mol
Từ (1)(2): Ta có hệ phương trình :
x+y = 0,25
x+y/2 = 0,2
Giải hệ trên ta có x = 0,15 mol
y= 0,1 mol
Khối lượng muối sau phản ứng sẽ bao gồm 2 muối là NaHSO3 và NA2SO3
Số mol Nahso3 = x = 0,15 mol
==> Khối lương NAHSO3 = 0,15 x 104 = 15,6 g
Số mol NA2SO3 = y/2 = 0,1 /2 = 0,05 mol
==> Khối lượng NA2SO3 = 0,05 x 126 = 6,3 g
Vậy khối lượng muối thu dc sau phản ứng là : 15,6 + 6,3 = 21,9 g


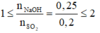 ⇒ phản ứng tạo 2 muối
⇒ phản ứng tạo 2 muối
Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x mol; nNaHSO3 = y mol
nNaOH = 2x + y = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,05, y = 0,15.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,05 x 126 = 6,3g.

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = CM(MnCl2)CM(MnCl2) = CM(NaClO) =0,80,50,80,5 = 1,6 mol/l
CM(NaOH)dư = 2.1,60,52.1,60,5 = 0,8 mol/l

a) (1) 2КСЮ3 \(\rightarrow\) 2KCl + 3O2 ; (2) S + O2 —> SO2
(3) SO2 + 2NaOH \(\rightarrow\) Na2SO3 + H2O
Phản ứng oxi hoá – khử là (1) và (2).
b) (1) S + H2 \(\rightarrow\) H2S ; (2) 2H2S + 3O2 \(\rightarrow\)2SO2 + 2H2O
(3) 2SO2 + O2 \(\rightarrow\) 2SO3 ; (4) SO3 + H2O \(\rightarrow\) H2SO4
Phản ứng oxi hoá – khử là : (1); (2); (3).

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
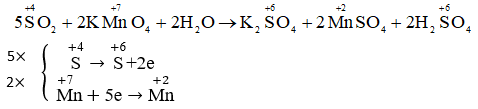
nSO2 = 12,8 / 64 = 0,2 mol.
nNaOH = 1 x250 / 1000 = 0,25 mol.
a) Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x; nNaHSO3 = y.
nNaOH = 2y + x = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,15, y = 0,05.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,5 x 126 = 63g.