Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

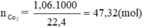
C + O2 → CO2
47,32 ← 47,32 (mol)
Theo pt: nC = nCO2 = 47,32 mol ⇒ mC = 47,32. 12 = 567,84 g
% khối lượng của C là:


C + O2 => CO2
1,06m3 = 1060 (l) => nCO2 = \(\frac{1060}{22,4}=47,32mol\)
nC = nCO2 = 47,32 mol
=> mC = 47,32.12 = 567,84 (g)
m than đá = 0,6kg = 600g
=> % C = \(\frac{567,84}{600}.100\%\) = 94,64%
C + O2 CO2
1,00mol 1,00mol
47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: = 94,6%

C + O2 \(\xrightarrow[]{t^o}\) CO2
nCO2 = \(\dfrac{1,06}{22,4}\approx0,047mol\)
Theo pt: nC = nCO2 = 0,047 mol
=> mC = 0,047.12 = 0,564g
%mC = \(\dfrac{0,564}{0,6}.100\%=94\%44\)

Theo thuyết A-rê-ni-ut thì:
– Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl–
– Bazơ là chất khi tan trong nước phân li ra anion OH–
Ví dụ : NaOH → Na+ + OH–
– Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +20H– ; Zn(OH)2 ⇔ ZnO2-2 + 2H+
2. Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4….
Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH– gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,….
3. Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ : Na2CO3 → 2Na+ + CO32-
Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axil.

a) C2H4 + O2 -> CH3CHO
Hỗn hợp khí X gồm C2H4 chưa phản ứng và CH3CHO. Khi X tác dụng với dung dịch AgNO3/NH3
CH3CHO + 2AgNO3 + 3NH3 + H2O -> CH3COONH4 + 2Ag + 2NH4NO3
Số mol Ag = 0,150 mol. Vậy số mol CH3CHO = 0,0750 mol
Hiệu suất của quá trình oxi hóa etilen :  .100% = 75%
.100% = 75%

Khối lượng của 1,00 lit nước là:
m = D.V = 1,00g/cm3.1000cm3 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18(100 - 25) = 313.500(J)
Đó là nhiệt lượng mà khí metan khi đốt cháy cầ phải toả ra.
Khối lượng metan cần phải đốt cháy là:


C + O2 →( t∘) CO2
1,00mol 1,00mol
47,3 mol \(\dfrac{1,06\cdot10^3}{22,4}\) = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: \(\dfrac{47,3\cdot12,0\cdot100}{600}\) = 94,6%