Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.

Ta có; 0,5y ứng với 2% nên y ứng với 4%
Vậy O3 chiếm 4%, O2 chiếm 96%.

Đáp án B
Phương trình hóa học: 2 O 3 → 3 O 2
Theo phương trình thì 2 phân tử O3 mất đi sẽ sinh ra 3 phân tử O 3 Số phân tử khí tăng = 3 - 2 = 1 => Số phân tử O3 mất đi = 2 lần số phân tử khí tăng

Phần trăm thể tích O3 trong hỗn hợp ban đầu là:
![]()

Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: 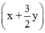 mol
mol
Số mol tăng là: 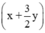 - (x + y) = 0,5y.
- (x + y) = 0,5y.

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

Đặt số mol O2 ban đầu và số mol O3 ban đầu lần lượt là a mol và b mol.
Xét 1 mol hỗn hợp ⇒a+b=1⇒a+b=1
2O3→3O2b→1,5b2O3→3O2b→1,5b
Vì O3 đã bị phân hủy hết nên sau phản ứng:
Quảng cáo
O2 (a + 1,5b) (mol)
Số mol khí tăng thêm: (a + 1,5b) – (a + b) = 0,5b mol
Theo đề bài:
%Vtăng thêm = 0,5b.100(a+b)=2⇒b=0,04⇒a=0,940,5b.100(a+b)=2⇒b=0,04⇒a=0,94
Thành phần phần trăm thể tích các khí trong hỗn hợp đầu
%VO3=0,04.1001=4%,%VO2=96%

Lời giải.
a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2 không cùng tồn tại trong một bình chứa vì H2S là chất khử mạnh, SO2 là chất oxi hóa.
2H2S + SO2 -> 3S + 2H2O.
b) Khí oxi O2 và khí Cl2 có thể tồn tại trong một bình chứa vì O2 không tác dụng trực tiếp với Cl2.
c) Khí HI và Cl2 không tồn tại trong cùng một bình chứa vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh.
Cl2 + 2HI -> 2HCl + I2.
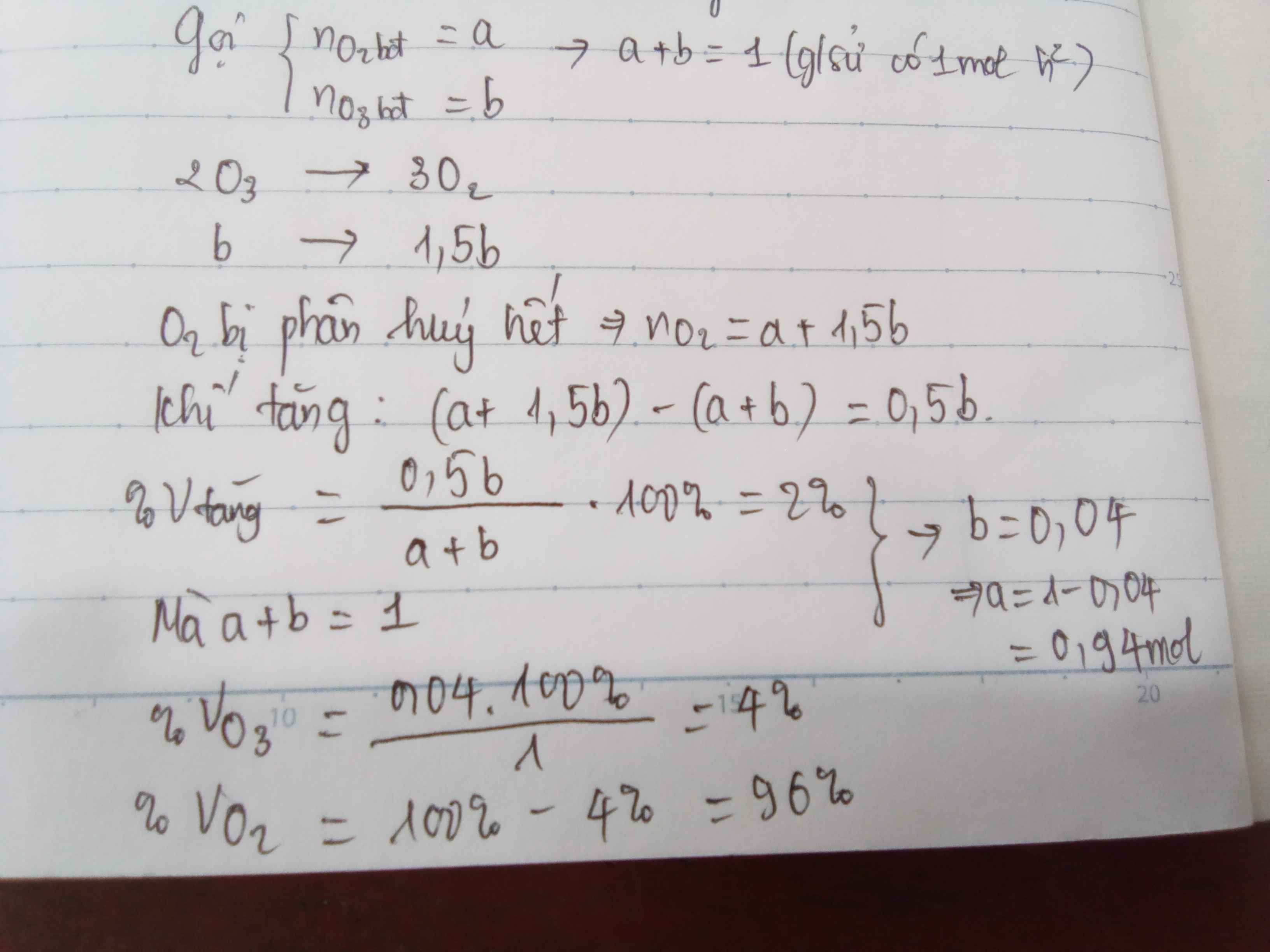
a) Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: (x+ 3/2y) mol
Số mol tăng là: (x+ 3/2y) - (x +y) = 0,5y.
b) Ta có; 0,5y ứng với 2% nên y ứng với 4%
vậy O3 chiếm 4%, O2 chiên 96%.