Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

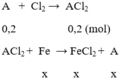
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 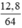 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 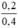 = 0,5M
= 0,5M

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.
a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.

Khí X là CO2
Áp dụng định luật bảo toàn khối lượng: 14,2 = 7,6 + mx => mx = 6,6 gam =>nx = 0,15 mol
Vì nKOH : nCO2 = 0,1: 0,15 <1 => muối thu được là KHCO3
CO2 + KOH = KHCO3
Vậy m KHCO3 = 0,1.100 = 10 gam.

Khi hòa tan X vào nước ta có phản ứng:
K + H2O --> KOH + (1/2)H2 ↑ (1)
Al + KOH + H2O --> KAlO2 + (3/2)H2 ↑ (2)
x ---- x
- - -
dung dịch A thu được gồm KAlO2 và KOH còn dư
khi cho HCl vào A, thì phản ứng trung hòa xãy ra trước, các pứ như sau:
HCl + KOH --> KCl + H2O (3)
HCl + KAlO2 + H2O --> KCl + Al(OH)3 ↓ (4)
3HCl + Al(OH)3 --> AlCl3 + 3H2O (5)
theo đề bài phản ứng (1) xãy ra xong, vừa bắt đầu có ↓ nên HCl vừa đủ cho pứ (3)
=> số mol HCl cho pứ (3) là 0,1*1 = 0,1 mol = mol KOH trong A
Gọi x là số mol Al => mol KOH (pư2) = x
=> mol KOH tạo thành từ (1) = x + 0,1
(ta hiểu KOH tạo ra từ (1), một phần cho pứ với Al ở (2), phần còn lại pứ với HCl)
từ (1) => mol K = x + 0,1
ta có: mX = 27x + 39(x+0,1) = 10,5 => x = 0,1
=> mAl = 27*0,1 = 2,7
%Al = 2,7*100 /10,5 = 25,71 %
% K = 74,29 %

Đáp án B.
Ta có nNO = 4,48 / 22,4 = 0,2 mol.
3M + 4HNO3 → 3M(NO3)n + nNO + 2H2O.
nM = 0,6 / n.
MM = 32n.
=> n=2 => M = Cu.

Nhúng một thanh sắt nặng 100 gam vào 100ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một hời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam( giả thiết các kim loại tạo thành đều bám hết vào thanh sắt ). Khối lượng sắt đã phản ứng là 1,40gam
 với các chất sau:
với các chất sau:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
Gọi số mol của Fe phản ứng với số mol của ACl2 là x
Khối lượng thanh sắt sau phản ứng là: 11,2 - 56x + xMA = 12
=> x =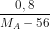
Ta có:
=> MA = 64 g/mol; Vậy kim loại A là Cu