


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


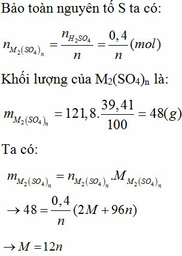


Phân tử khối của mỗi chất là: M = 1,875.32 = 60
Gọi CTPT là CxHyOz
+ z = 1: 12x + y = 44
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 44-12x ≤ 2x+2 => 3 ≤ x < 3,67 => x = 3
CTPT là C3H8O
+ z = 2: 12x + y = 28
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 28-12x ≤ 2x+2 => 1,857 ≤ x < 2,33 => x = 2
CTPT là C2H4O2
- Do X, Y, Z đều có khả năng phản ứng với Na nên có chứa nhóm –OH hoặc –COOH.
- Y tác dụng với dung dịch NaHCO3 nên Y là hợp chất axit. Công thức phân tử của Y là C2H4O2. Công thức cấu tạo của Y là CH3COOH.
- Khi oxi hóa X tạo X1 có khả năng tham gia phản ứng tráng gương nên X là ancol bậc 1. Công thức phân tử của X là C3H8O. Công thức cấu tạo của X là: CH3-CH2-CH2-OH.
- Chất Z có khả năng tham gia phản ứng tráng gương nên Z có chứa nhóm chức –CHO. Công thức phân tử của Z là C2H4O2. Công thức cấu tạo của Z là HO-CH2-CHO.
Chú ý:
+ Tác dụng với Na thì trong phân tử có nhóm – OH hoặc –COOH
+ Có phản ứng tráng bạc => trong phân tử có nhóm –CHO

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
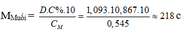
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
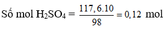
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Câu 1
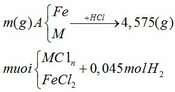
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
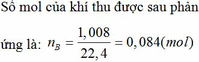
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
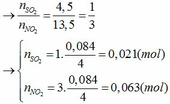
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
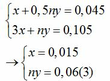
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Gọi số mol trong mỗi phần: Fe = x mol; M = y mol.
Phần 1:
Fe + 2HCl FeCl2 + H2
(mol): x x
2M + 2nHCl 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
(mol): x 1,5x
2M + 2nH2SO4 (đặc) M2(SO4)n + nSO2 + 2nH2O
(mol): y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09. Vậy x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78 nên My = 0,54. Vậy hay M = 9n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 9 ( loại ) | 18 ( loại ) | 27 ( nhận ) |
Vậy M là \(Al\) ( nhôm ) .
Đặt a là số mol Fe, b là số mol của M,trong mỗi phần,n là hóa trị của M
PTHH: Fe +2HCl ---> FeCl2 + H2
a a
2M + 2n HCl ---> 2 MCln + n H2
b bn/2
n H2= 0.07
---> a + bn/2 = 0.07 (1)
m hh A = 56a + Mb = 2.78 (2)
PTHH: Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O
a a
3M +4n HNO3 ---->3M(NO3)n +nNO + 2n H2O
b bn/3
n NO = a + bn/3 = 0.06 (3)
Từ (1) và (3) giải hệ ta dc : a= 0.04
bn = 0.06---> b= 0.06/n (4)
Thế à= 0.04vào pt (2) giải ra ta đc : 2.24 + Mb = 2.78
-----> b = 0.54/ M (5)
Từ (4) và (5) ----> M= 9n
Biện luận n
n=1 ----> M = 9 (loại)
n=2 ----> M= 18 (loại)
n=3-----> M=27 (nhận)
Do đó : M là Al

1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]

\(M_{NO}=M_{C2H6}=30\rightarrow M_{Y'}=1,35.30=40,5,y=0,04mol\)
Gọi x,y là số mol của NO,N2O trong hh ta có hệ:
\(\begin{cases}30x+44y=0,04.40,5\\x+y=0,04\end{cases}\) \(\Rightarrow n_{NO}=x=0,01,n_{N2O}=0,03\)
Gọi a,b là số mol của Fe,R trong 3,3 gam hỗn hợp:
\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(R+nHCl\rightarrow RCl_n+\frac{n}{2H2}\)
\(\Rightarrow56a+Rb=3,3\) (*)
\(\Rightarrow a+\frac{bn}{2}=0,12\) (**)
Hòa tan X trong HNO3
Quá trình oxi hóa
Fe →Fe3+ +3e
R→ Rn+ +ne
Quá trình khử:
NO3- +4H+ +3e → NO +2H2O
0,04 ← 0,03 ←0,01
NO3- +8H+ +8e → N2O +2H2O
0,3 ← 0,24 ←0,03
Áp dụng bảo toàn electron ta có
3a+ nb =0,27 (3)
Từ 2,3 → a=0,03 ,nb=0,18 thay vào 1 ta có: R=9n → n=3,R=27 → là Al
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
nHNO3du =0,01.0,34=0,034 mol=nH+ dư
cho NaOH vào Z
H+ + OH- → H2O
0,034→0,034
Fe3+ + 3OH- → Fe(OH)3
0,03→0,09→0,03
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- →AlO2- + 2H2O
Vì Fe(OH)3 kết tủa hết → nAl(OH)3 =(4,77-3,21)/78=0,02 mol < nAl3+ =0,06 mol → có 2 trường hợp
TH1 : Al3+ dư → nNaOH =0,034 +0,09 +0,06 =0,184 mol → CM(NaOH)=0,184/0,4=0,46M
TH2: Al3+ hết → nNaOH =0,034 +0,09 +0,18 +0,04 =0,344 mol → CM(NaOH)=0,344/0,4=0,86M