Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CHÚC BẠN HỌC TỐT!!![]()
Theo mình nghĩ thì là : Cu(OH)2CO3
a) PTHH: \(Cu\left(OH\right)_2CO_3\underrightarrow{o}2CuO+H_2O+CO_2\uparrow\)

Theo định luật bảo toàn khối lượng, khối lượng hai hợp chất của đồng phân hủy bằng:
m C u 2 O H 2 C O 3 = m C u O + m H 2 O + m C O 2 = 3,2 + 0,36 + 0,88 = 4,44(g)
Tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng:
mCu2(OH)2CO3 = (4,44 x 100)/ 4,8 = 92,5%

1. pthh
CuCO3+ H2O = CuO+ CO2 +H2O
nCO2= 2,22: (12+16.2)= 0,0504 mol
nH2O= 0,9:18= 0,05 mol
nCuO= 6:( 64+16) = o,1125 mol
Vì H20 nhỏ nhất (thiếu) nên các chất phản ứng, các chất tạo thành đều tính theo H2O
Theo pthh: nCuCO3= nH2O= 0.05 mol
mCuCO3= 0,05. (64+16.3)= 5,6g (lượng thu được theo pthh)
gọi lượng thu được thực tế là a, ta co:
a.\(\frac{100}{5,6}\)= 90
a= 5,04
=> khối lượng quặng đem nung là 5,04 g

Công thức hóa học của hai hợp chất của C u 2 O H 2 C O 3 → C u O H 2 v à C u C O 3
Các PTHH của phản ứng phân hủy:
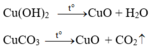

Câu 2:
a) 2Al(OH)3 \(\underrightarrow{to}\) Al2O3 + 3H2O
b) Al2O3 + 6HCl → 2AlCl3 + 3H2O
c) FeO + 2HCl → FeCl2 + H2O
a) 2Al(OH)3 to→to→ Al2O3 + 3H2O
b) Al2O3 + 6HCl → 2AlCl3 + 3H2O
c) FeO + 2HCl → FeCl2 + H2O

a/ PTHH: CaCO3 \(\underrightarrow{nung}\) CaO + CO2
b/Áp dụng định luật bảo toàn khối lương, ta có:
mCaCO3 = mCO2 + mCaO = 110 + 150 = 250kg
c/ %mCacO3 = \(\frac{250}{280}\) x 100% = 89,3%
Chúc bạn học tốt!!!

a,nCu(NO3)2=\(\dfrac{15.04}{188}\)=0.08(mol)
- Gọi số mol Cu(NO3)2 đã phản ứng là x.
⇒mCuO=80.x (g)
và mCu(NO3)2phản ứng =188.(0.08-x) (g)
- Theo bài ra, ta có:
mCuO+mCu(NO3)2=8.56(g)
⇒80.x + 188.(0.08-x) = 8.56
⇒80.x + 15.04 - 188x = 8.56
⇒108x = 6.48
⇒x=0.06 (mol)
⇒mCu(NO3)2pư=0.06⋅188=11.28(g)
⇒%mCu(NO3)2pư=\(\dfrac{11.28}{15.04}\)⋅100%=75%

A: X2On
%X=\(\frac{2X}{2X+16n}=\frac{11,11}{100}\)
=>X=n
=>X=1
n=1
=> H2O
B: %mH=\(\frac{2}{2+16n}=\frac{5,88}{100}\)
=>m=2
B:H2O2
H2O2->H2O+1/2O2
Quặng malachit có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là Cu2(OH)2CO3. Khi nung nóng thì hai hợp chất này bị phân huỷ, sản phẩm của phản ứng phân huỷ gồm có CuO, H2O và CO2.
a)Viết phương trình hoá học của phản ứng phân huỷ mỗi hợp chất của đồng.
b)Biết rằng khi nung nóng 4,8 kg quặng thì thu được 3,2 kg CuO cùng với 0,36 kg nước và 0,88 kg CO2. Tính tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng.
Giải
a) Công thức hóa học hai hợp chất của đồng:
(C{u_2}{(OH)_2}C{O_3} o Cu{(OH)_2}vàCuC{O_3})
Các phương trình hóa học của phản ứng phân hủy:
(Cu{(OH)_2} o CuO + {H_2}O)
(CuC{O_3} o CuO + C{O_2})
b) Theo định luật bảo toàn khối lượng, khới lượng hai hợp chất của đồng đã phân hủy bằng:
({m_{Cu}}_{_2{{(OH)}_2}C{O_3}} = {m_{CuO}} + {m_{{H_2}O}} + {m_{C{O_2}}} = 3,2 + 0,36 + 0,88 = 4,44(kg))
Tỷ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng bằng:
({m_{Cu}}_{_2{{(OH)}_2}C{O_3}} = {{4,44} over {4,8}} imes 100\% = 92,5\% ) .