Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1;
Xét với ½ khối lượng hỗn hợp
Mg→ Mg2++ 2e (1)
x__________2x mol
Al→ Al3++ 3e (2)
y_________3y mol
Cu→ Cu2++ 2e (3)
z_________ 2z mol
→ne cho= 2x+ 3y+2z mol
QT nhận e:
-Phần 1: nNO2=0,47 mol
N+5+ 1e→ NO2
____0,47__ 0,47 mol
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
-Phần 2:
Cl2+ 2e→ 2Cl-
___0,47___0,47
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
mmuối clorua= mkim loại+ mCl-= mkim loại+ 0,47.35,5=27,875
→ mkim loại=11,19 gam
→ m= 11,19.2=22,38 gam

Câu 1.
Ta gọi chung hh kim loại là X , ta có :
X + Cl- \(\rightarrow\) XCl
40__ 35,5a_____ 47,1
Bảo toàn KL ,ta có
mCl- = 35,5a = 47,1 - 40 = 7,1
\(\rightarrow\) nCl- = \(\frac{7,1}{35,5}\)= 0,2 mol
\(\rightarrow\) nHCl = nCl- = 0,2 mol \(\rightarrow\)CM dd HCl =\(\frac{0,2}{0,2}\) = 1(M)
X + HCl \(\rightarrow\) XCl + H2
40 ___0,2.36,5 ___47,1 ___2b
BTKL ta có : : 40 + 0,2.36,5 = 47,1 + 2b
\(\rightarrow\)b = 0,05 mol \(\rightarrow\) VH2 = 0,05.22,4 = 1,12 lit
Câu 2 . nH2SO4 = nH2O = \(\frac{1,8}{18}\) = 0,1 mol
Gọi hh các oxit kim loại là Y ,ta có :
Y + H2SO4 \(\rightarrow\) YSO4 + H2O
m___0,1.98_____80 _____ 1,8
BTKL : , ta có : m + 0,1.98 = 80 + 1,8
\(\rightarrow\)m = 72 gam

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4

Bài 1. Bài làm:
\(n_{H_2}=\frac{1}{22,4}=0,0446mol;n_{Cl_2}=0,03mol\)
H2 + Cl2 → 2HCl (1)
Vì \(n_{H_2}>n_{Cl_2}\Rightarrow\) hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl + HNO3
⇒ nHCl (trong 5g A) = nAgCl = 0,01 mol
⇒ nHCl (trong 20g A) = 0,01.4 = 0,04 mol
Từ (1)⇒ \(n_{Cl_2}\)phản ứng = 0,5.nHCl = 0,5.0,04 = 0,02 mol
⇒ H% = \(\frac{0,02}{0,03}\) .100% = 66,67%
Bài 2. Bài làm:
Dung dịch Y chỉ chứa KCl: 0,8mol → số mol HCl: 0,8mol
→ mddHCl\(=\frac{0,8.36,5}{0,146}=200gam\)
Khối lượng dung dịch Y là: mdd Y\(=\frac{59,6}{0,250841}=237,6gam\)
Bảo toàn khối lượng → \(m+200=237,6+15.2.0,3\rightarrow m=46,6gam\)

bài 1
Gọi số mol Cl2 và O2 lần lượt là x , y
=> x + y = 0,3 mol (1)
Ta có:
Bảo toàn e: ∑ne cho = ∑ne nhận
=> 2x+4y = 0,8 (2)
Từ (1) và (2) => x = 0,2 và y = 0,1
=> %mO2 = 0,1.32 : (0,1.32 + 0,2.71).100 = 18,4%
bài 2
Có:
Áp dụng định luật bảo toàn khối lượng ta có:
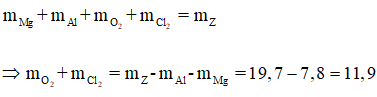
Gọi
Có:
Gọi
Có
Vậy

Giải tiếp:
\(n_{KMnO_4\left(1\right)}=0,2;n_{KClO_3}=0,25\left(mol\right)\)
\(KClO_3\underrightarrow{t^o}KCl+\frac{3}{2}O_2\)
0,25____________0,375
\(2KMnO_4\overset{t^o}{\rightarrow}K_2MnO_4+MnO_2+O_2\)
0,15____________________________0,075
\(\Rightarrow n_{KMnO_4\left(\text{dư}\right)}=0,05\left(mol\right)\Rightarrow\%KMnO_4\left(Y\right)=16,52\%\)

Đáp án: a
2Al + 6HCl -> 2AlCl3 + 3H2
Fe + 2HCl -> FeCl2 + H2
2Cu + 2HCl -> H2 + 2CuCl
2HCl + Zn -> H2 + ZnCl2
Ag + 2HCl -> 2AgCl + H2

Quy đổi hh cr gồm Fe dư và các oxit sắt thành hh chỉ gồm Fe và O vs số mol lần lượt là a và b mol
mhh cr=56a+16b=11,36
KHi cho hh cr tác dụng với HNO3 loãng
nNO=0,06 mol
N+5 +3e => N+2
0,18 mol<=0,06 mol
O +2e =>O-2
b mol=>2b mol
Fe =>Fe+3 +3e
a mol =>3a mol
ne nhường=ne nhận=>0,18+2b=3a
=>a=0,16 và b=0,15
Bảo toàn Fe nFe bđ=0,16 mol=>mFe=8,96g

nFe = x mol, nCu = y mol.
Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư),
sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa
một muối duy nhất. ==> chất rắn Z gồm Fe dư và Cu , khi cho qua H2SO4 loãng chất rắn giảm chính là Fe dư vì Cu ko phản ứng vs H2SO4 lãng mà dd sau đó lại chỉ chứa 1 muối.
nFe(dư) = 0,28/56 = 0,005 mol.
vì khi cho Fe vào Zn và dd CuSO4 Zn fản ứng hết thì mới tới Fe
và 1mol Fe---> 1mol Cu mhh tăng 8g , 1mol Zn ---> 1mol Cu mhh giảm 1 gam.
dùng tăng giảm khối lượng : (x - 0,005).8 - y = 0,14 (1)
và tổng khối lượng hh ban đầu = 2,7 ==> 56x + 65y = 2,7(2)
giải (1) và (2) ra x = 0,025 và y = 0,02.
%Fe = 0,025.56/(0,025.56 + 0,02.64). 100 = 52,24%
vì mZ >mX nên Zn phản ứng hết, Fe phản ứng 1 phần
gọi x, y là mol của Zn và Fe
theo đề bài ta có:
65x +56y+0,28= 2,7 (1)
64(x+y)+0,28=2,84 (2)
từ (1),(2)=>x=0,02
y=0,02
%mFe = (56.0,02+0,28)/2,7=51,85%