Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 \(\underrightarrow{to}\) MgO + CO2 (1)
CaCO3 \(\underrightarrow{to}\) CaO + CO2 (1)
Theo định luật bảo toàn khối lượng:
\(m_{hhA}=m_{cr}+m_{CO_2}\)
\(\Rightarrow m_{CO_2}=m_{hhA}-m_{cr}=73,8-40,8=33\left(g\right)\)
\(\Rightarrow n_{CO_2}=\dfrac{33}{44}=0,75\left(mol\right)\)
Gọi \(x,y\) lần lượt là số mol của MgCO3 và CaCO3
Theo PT1: \(n_{CO_2}=n_{MgCO_3}=x\left(mol\right)\)
Theo PT2: \(n_{CO_2}=n_{CaCO_3}=y\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}84x+100y=73,8\\x+y=0,75\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,075\\y=0,675\end{matrix}\right.\)
Vậy \(n_{MgCO_3}=0,075\left(mol\right)\) ; \(n_{CaCO_3}=0,675\left(mol\right)\)
\(\Rightarrow m_{MgCO_3}=0,075\times84=6,3\left(g\right)\) \(\Rightarrow\%m_{MgCO_3}=\dfrac{6,3}{73,8}\times100\%=8,54\%\)
\(m_{CaCO_3}=0,675\times100=67,5\left(g\right)\Rightarrow\%m_{CaCO_3}=\dfrac{67,5}{73,8}\times100\%=91,46\%\)

mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= \(\dfrac{10.2}{67}\cdot100=15.22\%\)
%Fe2O3=\(\dfrac{9.8}{67}\cdot100=14.62\%\)
mCaO = 0.75*56=42g
=> %mCaO = 42%
mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= 10.267⋅100=15.22%10.267⋅100=15.22%
%Fe2O3=9.867⋅100=14.62%9.867⋅100=14.62%
%CaCO3dư = \(\dfrac{5}{67}\cdot100=7.4\%\)
=>%CaO=62.69%

PT: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\left(1\right)\)
mol x x
\(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\left(2\right)\)
mol y y
Gọi x và y lần lượt là số mol của CaCO3 và MgCO3 (x,y>0)
Theo đề và phương trình (1), (2) ta có:
\(n_{CO_2}=\frac{4,48}{22,4}=0,2\left(mol\right)\Rightarrow x+y=0,2\left(1'\right)\)
\(m_{CaCO_3}+m_{MgCO_3}=m_{hh}=18,4\left(g\right)\\ \Leftrightarrow100x+84y=18,4\left(2'\right)\)
Từ (1') và (2') ta có hệ phương trình:
\(\left\{{}\begin{matrix}x+y=0,2\\100x+84y=18,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
Suy ra \(m_{CaCO_3}=100\cdot0,1=10\left(g\right)\Rightarrow\%m_{CaCO_3}=\frac{10}{18,4}\cdot100\%\approx54,35\%\\ \Rightarrow\%m_{MgCO_3}=100\%-\%m_{CaCO_3}\approx45,65\%\)

a) CaCO3---->CaO+CO2
x---------------------------x
MgCO3----->MgO+CO2
y------------------------y
b)
n\(_{CO2}=\frac{16,8}{22,4}=0,75\left(mol\right)\)
Theo bài ra ta có pt
\(\left\{{}\begin{matrix}100x+84y=71\\x+y=0,75\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,5\\y=0,25\end{matrix}\right.\)
%m\(_{CaCO3}=\frac{0,5.100}{71}.100\%=70,42\%\)
%m\(_{MgCO3}=100-70,42=29,58\%\)
\(\)\(\text{a) CaCO3 -> CaO + CO2}\)
\(\text{MgCO3 -> MgO + CO2}\)
Gọi số mol CaCO3 và MgCO3 lần lượt là x, y
\(\text{-> 100x+84y=71}\)
Theo ptpu: nCO2=nCaCO3+nMgCO3=x+y=16,8/22,4=0,75 mol
\(\text{Giải được: x=0,5; y=0,25}\)
\(-\text{> %CaCO3=0,5.100/71=70,4% -> %MgCO3=29,6% }\)

PTHH: CaCO3 → CaO + CO2 ↑
MgCO3 → MgO + CO2 ↑
Gọi số mol của MgCO3 là a, số mol của CaCO3 là b
=> Số mol của CO2 sinh ra ở pt(1) là a , số mol CO2 sinh ra ở pt(2) là b
Số mol của CO2 là: 3,36 : 22,4 = 0,15 mol
Ta có hệ phương trình sau:
- 100a + 84b = 14,2
- a + b = 0,15
=> a = 0,1 mol , b = 0,05 mol
Khối lượng của CaCO3 là: 0,1 . 100 = 10gam
%CaCO3 trong hỗn hợp ban đầu là:
(10 : 14,2).100% = 70,423%
%MgCO3 trong hỗn hợp ban đầu là:
100% - 70,423% = 29,577%

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

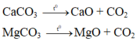
Gọi số mol C a C O 3 và M g C O 3 lần lượt là a và b mol
→ 100a + 84b = 30 (gam) (1)
Theo bài ra khối lượng chất rắn sau phản ứng là 30 : 2 = 15 gam
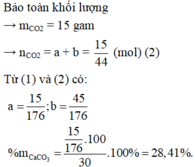
⇒ Chọn A.

Giả sử m=100 gam chứa x mol CaCO3 và y mol MgCO3
CaCO3 \(\rightarrow\) CaO + CO2
MgCO3\(\rightarrow\) MgO + CO2
\(\rightarrow\)100x+84y=100
Rắn còn lại là CaO x mol và MgO y mol nặng 53,52 gam
\(\rightarrow\)56x+40y=53,52
Giải được: x=0,704; y=0,352
\(\rightarrow\) mCaCO3=100x=70,4 gam
\(\rightarrow\)%mCaCO3=\(\frac{70,4}{100}\)=70,4%

gọi số mol CaCO3 là x, số mol MgCO3 là y
CaCO3 -> CaO + CO2\(\uparrow\)
x -> x -> x
MgCO3 -> MgO + CO2\(\uparrow\)
y -> y -> y
ta có pt:
56x + 40y = (100x + 84y)/2
<=> 112x + 80y = 100x + 84y
<=> 12x = 4y
<=> 3x = y
=> % CaCO3 là 100/4 * 3 = 75%
% MgCO3 là 25%