Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{NaOH\left(A\right)}=20.5\%=1\left(g\right)\)
Trong B:
gọi x là khối lượng Na2O thêm vào , x>0 (g)
\(10\%=\dfrac{\dfrac{80}{62}x+1}{x+20}\)
\(\rightarrow x=0,84\left(g\right)\)
Vậy khối Na2O thêm vào dd A là 0,84 (g)
b, \(m_{KOH\left(A\right)}=2\%.20=0,4\left(g\right)\)
\(C\%_{KOH\left(B\right)}=\dfrac{0,4}{20+0,84}.100\%=1,92\%\)

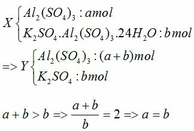
Vì dung dịch sau phản ứng chỉ chứa một chất tan => Z chỉ chứa KAlO2 hoặc K2SO4.
Khi cho từ từ Ba(OH)2 vào Y thì có thể xảy ra các phản ứng:
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaSO4(1)
2b → 6b 4b 6b (mol)
K2SO4 + Ba(OH)2 → 2KOH + BaSO4 (2)
b → b 2b b (mol)
Al(OH)3 + KOH → KAlO2 + 2H2O (3)
2b →2b 2b (mol)
· Trường hợp 1: Chất tan trong Z là K2SO4 → vừa đủ phản ứng (1)
Theo đề => a= b = 0,02 mol
nBaSO4 = nBa(OH)2 = 6b = 0,12mol
nAl(OH)3 = 4b = 0,08mol
m1= 948 . 0,02 + 342 . 0,02 = 25,8 gam
m2 = 0,08 . 78 + 0,12 . 233 = 34,2 gam
V = 0,12/2 = 0,06 lít = 60ml
· Trường hợp 2: Chất tan trong Z là KAlO2 →xảy ra cả (1,2,3)
nKAlO2 = 0,02mol
=> 2b = 0,02 => a = b =0,01
nBaSO4 = nBa(OH)2 = 7b = 0,07
nAl(OH)3 = 4b – 2b = 0,02
=> m1= 948.0,01 + 342.0,01 = 12,9 gam
m2 = 0,02.78 + 0,07.233 = 17,87 gam
V = 0,07/2 = 0,035 lít = 35ml

a/ A+ HCl
CO3 2- + 2H+ ---> H2O+ CO2
dd B trung hòa bởi NaOH--> trong B có Ba(HCO3)2
CO2 + Ba(OH)2 --> BaCO3 + H2O
0.2<---0.25-0.05-------->0.2
2Co2+ Ba(OH)2--> Ba(HCO3)2
0.1<--------0.05<---------0.05
Ba(HCO3)2+ 2NaOH---> BaCO3+ Na2CO3+ 2H2O
0.05<-------------0.1
--> m2= 0.2*197=39,4g
Na2CO3 va K2CO3 : x,y mol
x+y=0.3
138y=106x*2,604
-->x=0.1,y=0.2
--> m1=0.1*106+ 0,2*138=38,2
b/
C%Na2CO3= (0.1*106*100)/ (61,8+ 38,2)=10,6%
C%K2CO3=(0.2*138*100)/(61,8+ 38,2)=27,6%

-Cho BaCl2 vào
+MT tạo kết tủa là H2SO4 và K2CO3(n1)
+MT k có ht là HCL và KOH(N2)
-Cô cạn N1
+MT có cặn là K2CO3
+K có cặn là H2SO4
-Cho K2CO3 vào N2
+Có khí là HCl
+K ht là KOH

Gọi số mol KHCO3, K2O là a, b (mol)
\(n_{BaCO_3}=\dfrac{11,82}{197}=0,06\left(mol\right)\)
Bảo toàn C: \(n_{KHCO_3\left(bđ\right)}=0,06\left(mol\right)\)
=> a = 0,06 (mol)
TH1: X chứa K2CO3, KOH
PTHH: K2O + H2O --> 2KOH
b------------->2b
KOH + KHCO3 --> K2CO3 + H2O
0,06<--0,06----->0,06
=> X chứa \(\left\{{}\begin{matrix}K_2CO_3:0,06\left(mol\right)\\KOH:2b-0,06\left(mol\right)\end{matrix}\right.\)
Do 2 chất tan có cùng nồng độ mol
=> Số mol 2 chất tan bằng nhau
=> 2b - 0,06 = 0,06
=> b = 0,06 (mol)
m = 0,06.100 + 0,06.94 = 11,64 (g)
TH2: X chứa K2CO3, KHCO3
PTHH: K2O + H2O --> 2KOH
b------------->2b
KOH + KHCO3 --> K2CO3 + H2O
2b---->2b------->2b
=> X chứa \(\left\{{}\begin{matrix}KHCO_3:0,06-2b\left(mol\right)\\K_2CO_3:2b\left(mol\right)\end{matrix}\right.\)
=> 0,06 - 2b = 2b
=> b = 0,015 (mol)
=> m = 0,06.100 + 0,015.94 = 7,41 (g)

\(\text{nBa(OH)2 = 0,5.0,5 = 0,25 mol}\)
\(\text{nNaOH = 0,05.2 = 0,1 mol}\)
Đặt mol của Na2CO3, K2CO3 lần lượt là x, y (mol)
\(\text{+ Ta có: 138y = 2,604.106x}\Rightarrow\text{ 276,024x - 138y = 0 (1)}\)
\(\text{PTHH: (1) Na2CO3 + 2HCl → 2NaCl + H2O + CO2}\)
\(\text{(2) K2CO3 + 2HCl → 2KCl + H2O + CO2}\)
\(\text{ (3) CO2 + Ba(OH)2 → BaCO3 + H2O}\)
\(\text{ 0,2 ← 0,2 → 0,2}\)
\(\text{(4) 2CO2 + Ba(OH)2 → Ba(HCO3)2}\)
\(\text{0,1 ← 0,05 ← 0,05}\)
\(\text{ (5) Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O}\)
\(\text{ 0,05 ← 0,1}\)
Theo (1) (2): nCO2 = nNa2CO3 + nK2CO3 => x + y = 0,2 + 0,1 (2)
Ta có hpt
\(\Rightarrow\left\{{}\begin{matrix}276,024x-138y=0\\x+y=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\text{a) m1 = 0,1.106 + 0,2.138 = 38,2 gam}\)
\(\text{m2 = mBaCO3(3) = 0,2.197 = 39,4 gam}\)
b) Dung dịch A chứa: Na2CO3 (0,1 mol) và K2CO3 (0,2 mol)
m dd A = mNa2CO3 + mK2CO3 + mH2O = 38,2 + 61,8 = 100 gam
\(\Rightarrow\left\{{}\begin{matrix}\text{ C% Na2CO3 = (0,1.106/100).100% = 10,6%}\\\text{C% K2CO3 = (0,2.138/100).100% = 27,6%}\end{matrix}\right.\)
c) Theo (1) (2): nHCl pư = 2(nNa2CO3 + nK2CO3) = 2.(0,1 + 0,2) = 0,6 mol
\(\Rightarrow\text{V dd HCl = 0,6 : 2 = 0,3 lít = 300 ml}\)
d) Đặt khối lượng Na2CO3 cần thêm vào A để nồng độ Na2CO3 là 27,6% là m (g)
\(\Rightarrow\frac{0,1.106+m}{100+m}.100\%=27,6\%\)
\(\Rightarrow\text{m = 23,48 gam}\)