Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

Cho 16,2 gam kim loại M có hóa trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl dư thấy thoát ra 13,44 lít H2 (đktc). Kim loại M là
A. Fe
B. Al
C. Ca
D. Mg

Giả sử KL có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}nH_2=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,8}{\dfrac{0,4}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MM = 24 (g/mol) là tm
Vậy: M là Mg.
Ta có: \(n_{MgCl_2}=n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,2.95=19\left(g\right)\)

C. Gọi kim loại cần tìm là R. Các PTHH:
R + H2SO4 → RSO4 +H2 (1)
H2SO4 + 2NaOH → Na2SO4 + H2O (2)
Số mol của H2SO4 bằng: 0,15.0,5 = 0,075 (mol);
Số mol của NaOH bằng: 0,03.1 = 0,03 (mol)
=> Số mol của H2SO4 ở (1) bằng: 0,075 - = 0,06 (mol).
Từ (1) => nR = = 0,06; mR =
= 24 (g/mol)
Vậy R là Mg
Hòa tan 1,44 gam một kim loại hóa trị II trong 150 ml dung dịch H2SO4 0,5M. Để trung hòa axit dư trong dung dịch thu được thì phải dùng hết 30ml dung dịch NaOH 1M. Kim loại đó là
A. Ba
B. Ca
C. Mg
D. Be

đề cho có bị sai số liệu không?
Thể tích khí Cl2 sao lại là 13,32(l) ????
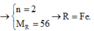
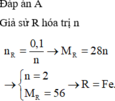
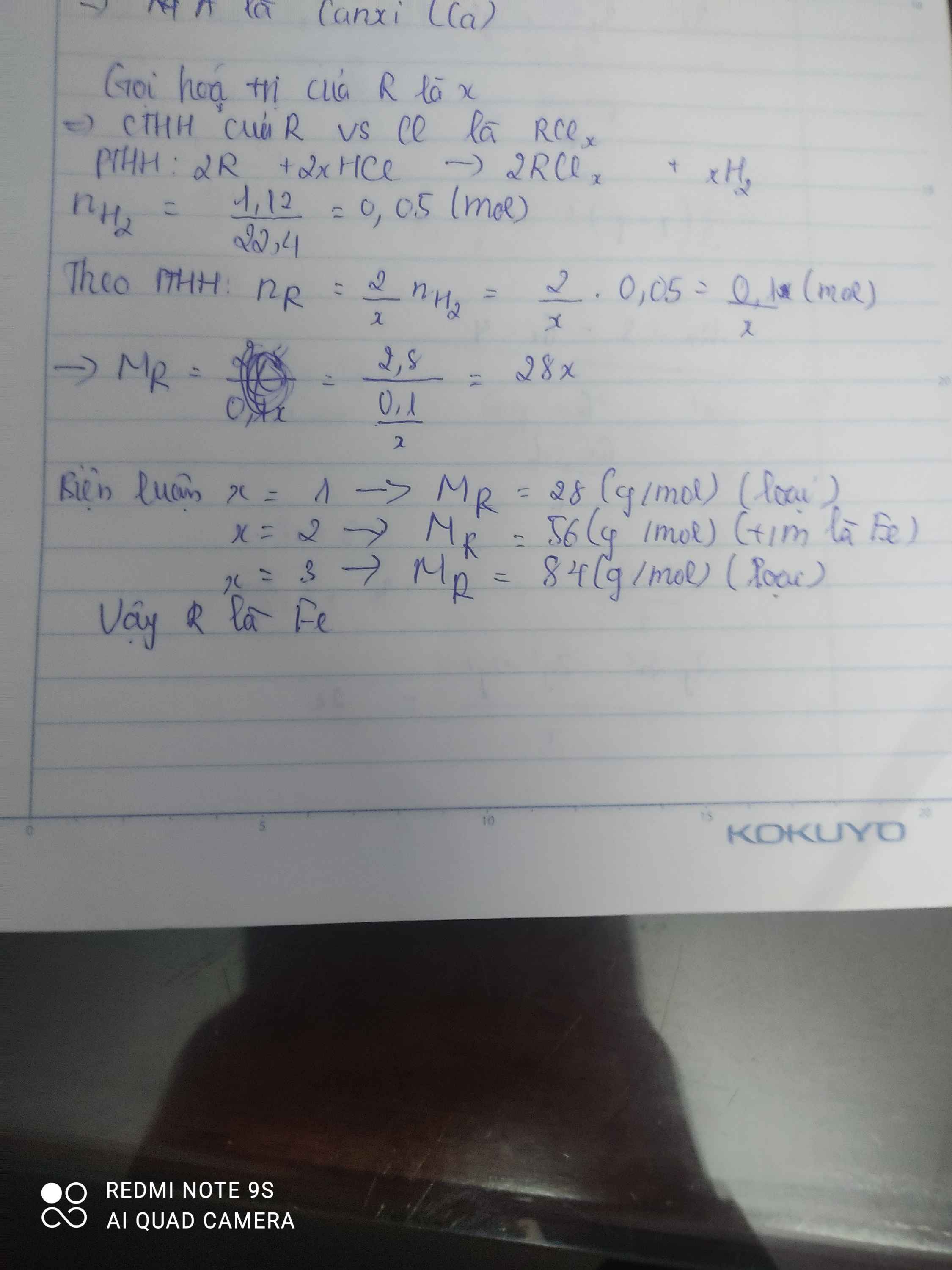
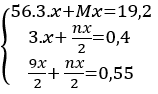
nH2=0,45 mol
PTHH : 2 M + 2x HCl -->2 MClx + xH2
mol 0,9/x 0,45
mX = 0,9/x *M = 25,2 g
=> M=28x
lập bảng tính được M=56 , x=2
vậy M là Sắt ( Fe)