Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.nH2=5.04/22.4=0.225mol
Đặt x,y lần lượt là số mol của Al,Mg
a)2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
x 3/2 x
Mg+ H2SO4 --> MgSO4 + H2
y y
b) theo đề, ta có hệ pt: 27x + 24y= 4.5
1.5x + y =0.225
giải hệ pt trên,ta có :x=0.1 ; y=0.075
thay vào pt,suy ra :
mAl=0.1*27=2.7g =>%Al=(2.7/4.5)*100=60%
=>%Mg=40%
vậy % của Al,Mg lần lượt là 60% và 40%
2.nAl=5.4/27=0.2mol
nH2SO4=0.5*0.1=0.05 mol
pt:2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0.2 0.05 0.02 0.05
a)theo pt, ta thấy Al dư
VH2=0.05*22.4=1.12 l
b)CMAl2(SO4)3= 0.02/0.1=0.2M
Bài này không khó đâu nh,tính theo pthh thôi à.
Chúc em học tốt!!!:))

a) \(n_{CuO}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
\(m_{H_2SO_4}=100.29,4\%=29,4\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: 0,03 0,03 0,03
Ta có: \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\) ⇒ CuO hết, H2SO4 dư
b) \(m_{H_2SO_4}=0,03.98=2,94\left(g\right)\)
c) mdd sau pứ = 2,4+100 = 102,4 (g)
\(C\%_{ddCuSO_4}=\dfrac{0,03.160.100\%}{102,4}=4,6875\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,3-0,03\right).98.100\%}{102,4}=25,84\%\)
Bài 4 :
\(n_{CuO}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
\(m_{ct}=\dfrac{29,4.100}{100}=29,4\left(g\right)\)
\(n_{H2SO4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
a) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,03 0,3 0,03
Câu khối lượng của dng dịch H2SO4 đề cho rồi nên mình làm câu c thôi nhé
c) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuSO4}=\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
⇒ \(m_{CuSO4}=0,03.160=4,8\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,3-0,03=0,27\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,27.98=26,46\left(g\right)\)
\(m_{ddspu}=2,4+100=102,4\left(g\right)\)
\(C_{CuSO4}=\dfrac{4,8.100}{102,4}=4,6875\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{26,46.100}{102,4}=25,84\)0/0
Chúc bạn học tốt

\(a)CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ b)n_{CuO}=\dfrac{4}{80}=0,05mol\\ n_{H_2SO_4}=\dfrac{100.20}{100.98}=\dfrac{10}{49}mol\\ \Rightarrow\dfrac{0,05}{1}< \dfrac{10:49}{1}\rightarrow H_2SO_4.dư\\ n_{CuSO_4}=n_{H_2SO_4}=n_{CuO}=0,05mol\\ C_{\%CuSO_4}=\dfrac{0,05.160}{100+4}\cdot100=7,69\%\\ C_{\%H_2SO_4}=\dfrac{\left(10:49-0,05\right)98}{100+4}\cdot100=14,52\%\)

\(n_{H_2SO_4}=\dfrac{200.19,6}{100.98}=0,4mol\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4\left(A\right)}=n_{CuO}=n_{H_2SO_4}=0,4mol\\ n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\\\Rightarrow\dfrac{0,4}{1}>\dfrac{0,3}{1}\Rightarrow CuSO_4.pư.không.hết\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,3mol 0,6mol 0,3mol
\(m_{ddB}=0,4.80+200+0,6.40-29,4=226,6g\\ C_{\%Na_2SO_4\left(B\right)}=\dfrac{0,3.142}{226,6}\cdot100=18,8\%\)

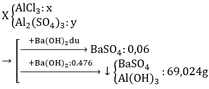
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952




nCuO=2,4/80=0,03(mol)
m(H2SO4)=29,4%.100=29,4(g) -> nH2SO4=29,4/98=0,3(mol)
a) PTHH: CuO + H2SO4 -> CuSO4 + H2O
Ta có: 0,03/1 < 0,3/1
b)=> CuO hết, H2SO4 dư => Tính theo nCuO
nH2SO4(p.ứ)=nCuSO4=nCuO=0,03(mol)
=>nH2SO4(dư)=0,3-0,03=0,27(mol)
=>mH2SO4(dư)=0,27. 98= 26,46(g)
b) mCuSO4=0,03.160= 4,8(g)
mddsau= 2,4+ 100=102,4(g)
C%ddCuSO4= (4,8/102,4).100=4,6875%
C%ddH2SO4(dư)= (26,46/102,4).100= 25,84%
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{29,4.100}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
a) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,03 0,3 0,03
b) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
Số mol dư của axit sunfuric
ndư = nban đầu - nmol
= 0,3 - (0,03 . 1)
= 0,27 (mol)
Khối lượng dư của axit sunfuric
mdư = ndư . MH2SO4
= 0,27 . 98
= 26,46 (g)
c) Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
Khối lượng của đồng (II) sunfat
mCuSO4 = nCuSO4 . MCuSO4
= 0,03 . 160
= 4,8 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + mH2SO4
= 2,4 + 100
= 102,4 (g)
Nồng độ phần trăm của đồng (II) sunfat
C0/0CuSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,8.100}{102,4}=4,6875\)0/0
Nồng độ phần trăm của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{26,46.100}{102,4}=25,84\)0/0
Chúc bạn học tốt