Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Bài 1
Khí hydro khử sắt ( III ) oxit ở nhiệt độ cao thu được sắt và nước
Để tiến hành thí nghiệm người ta dùng 12g khí hydro và 480g sắt (III) oxit
a) Tính khối lượng chất dư sau phản ứng
b) Tính khối lượng sắt tạo thành
c) Chất dư đc cho tác dụng với axit ( HCl ). Tính khối lượng muối sắt ( III ) clorua ( #Hỏi cộng đồng OLM #Hóa học lớp 8

nH2= \(\frac{12}{2}\)= 6 mol
nFe2O3= \(\frac{480}{160}\)= 3 mol
PTHH:
Fe2O3+ 3H2→ 2Fe+ 3H2O
2_____6 ____ 4
mFe2O3 dư= (3-2).160= 160 g
mFe= 4.56=224 g
PTHH:
Fe2O3+ 6HCl→ 2FeCl3+ 3H2O
mFeCl3= 1.162,5.98%=159,25 g

Coi oxit sắt gồm hai nguyên tố Fe,O
Bản chất là O trong oxit tác dụng với H trong axit để tạo nước.
\(2H + O \to H_2O\)
\(n_H = n_{HCl} = \dfrac{4,38}{36,5} = 0,12(mol)\)
Theo PTHH :
\(n_O = \dfrac{1}{2}n_H = 0,06(mol)\)
\(\Rightarrow n_{Fe} = \dfrac{3,2-0,06.16}{56} = 0,04(mol)\)
Ta có :
\(\dfrac{n_{Fe}}{n_O} = \dfrac{0,04}{0,06} = \dfrac{2}{3}\)
Vậy oxit sắt cần tìm : \(Fe_2O_3\)

\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PT: 3Fe + 2O2 ➝ Fe3O4
Trước 0,15 0,05 0 mol
Trong 0,075 0,05 0,025 mol
Sau 0,075 0 0,025 mol
a) \(m_{Fe_3O_4}=0,025.232=5,8\left(g\right)\)
b) Sắt còn dư sau phản ứng
mFe dư = 0,075.56 = 4,2 (g)

Hòa tan hoàn toàn 11,2 g sắt vào 100 ml dung dịch HCl. Hãy:
a, Tính lượng khí H #Hỏi cộng đồng OLM #Hóa học lớp 8


Gọi CTHH của oxit là \(R_xO_y\left(x,y\in N\text{*},\text{2y/x là hoá trị của kim loại R}\right)\)
\(n_{HCl}=1,5.0,2=0,3\left(mol\right)\)
PTHH: \(R_xO_y+2yHCl\rightarrow xRCl_{2y\text{/}x}+yH_2O\)
\(\dfrac{0,15}{y}\)<--0,3
\(\rightarrow n_R=xn_{R_xO_y}=x.\dfrac{0,15}{y}=\dfrac{0,15x}{y}\left(mol\right)\)
Theo PTHH: \(n_O=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,3=0,15\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT}}m_R=8-0,15.16=5,6\left(g\right)\)
\(\rightarrow M_R=\dfrac{5,6}{\dfrac{0,15x}{y}}=\dfrac{112y}{3x}=\dfrac{56}{3}.\dfrac{2y}{x}\left(g\text{/}mol\right)\)
Vì 2y/x là hoá trị R nên ta có:
| \(\dfrac{2y}{x}\) | 1 | 2 | 3 | \(\dfrac{8}{3}\) |
| \(\dfrac{56}{3}\) | \(\dfrac{112}{3}\) | 56 | \(\dfrac{896}{9}\) | |
| Loại | Loại | Sắt (Fe) | Loại |
=> R là Fe
\(\rightarrow\dfrac{2y}{x}=3\Leftrightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Do \(x,y\in N\text{*}\rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\)
Vậy CTHH của oxit là \(Fe_2O_3\)
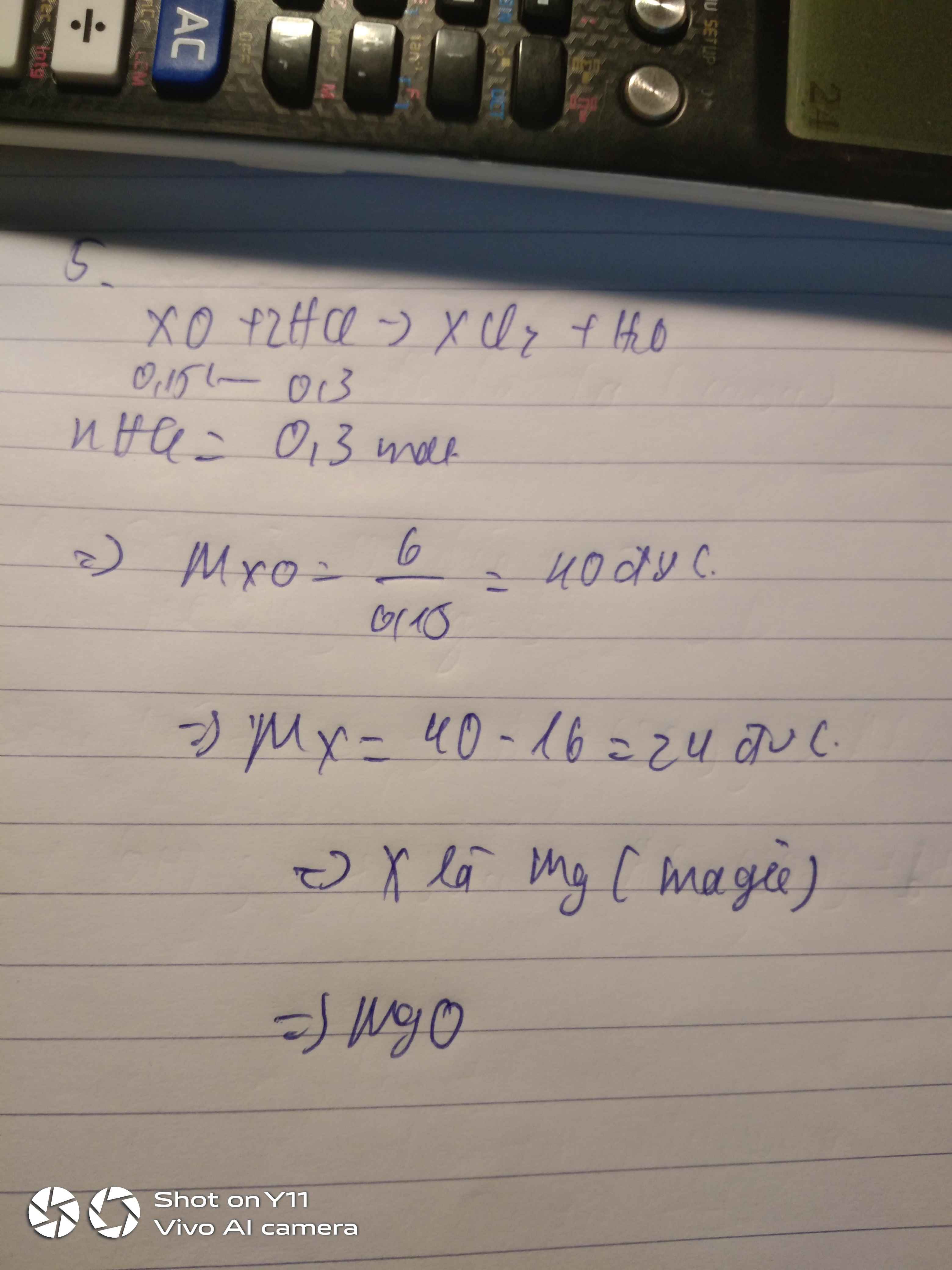
Gọi CTHH của oxit sắt là FexOy (Fe có hóa trị \(\dfrac{2y}{x}\) )
PTHH: FexOy + 2yHCl ===> xFeCl2y/x + yH2O
Theo PT, nFexOy = \(\dfrac{0,45}{2y}=\dfrac{0,225}{y}\left(mol\right)\)
=> MFexOy = \(12\div\dfrac{0,225}{y}=\dfrac{160}{3}y\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow56x+16y=\dfrac{160}{3}y\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTHH: Fe2O3