Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(v_{thuận}=k_{thuận}\left[A\right]^a\left[B\right]^b\\ v_{nghịch}=k_{nghịch}\left[C\right]^c\left[D\right]^d\\\dfrac{k_{thuận}}{k_{nghịch}} =\dfrac{\left[C\right]^c\left[D\right]^dv_{thuận}}{\left[A\right]^a\left[B\right]^bv_{nghịch}}\)
aA+bB ⇌ cC + dD
- Tốc độ phản ứng thuận ở trạng thái cân bằng: \({{\rm{v}}_{\rm{t}}}{\rm{ = }}{{\rm{k}}_{\rm{t}}}{{\rm{(A)}}^{\rm{a}}}{{\rm{(B)}}^{\rm{b}}}\)
- Tốc độ phản ứng nghịch ở trạng thái cân bằng: \({{\rm{v}}_{\rm{n}}}{\rm{ = }}{{\rm{k}}_{\rm{n}}}{{\rm{(C)}}^{\rm{c}}}{{\rm{(D)}}^{\rm{d}}}\)
- Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch:
\(\begin{array}{l}{\rm{ }}{{\rm{v}}_{\rm{t}}}{\rm{ = }}{{\rm{v}}_{\rm{n}}}\\ \Leftrightarrow {{\rm{k}}_{\rm{t}}}{{\rm{(A)}}^{\rm{a}}}{{\rm{(B)}}^{\rm{b}}}{\rm{ = }}{{\rm{k}}_{\rm{n}}}{{\rm{(C)}}^{\rm{c}}}{{\rm{(D)}}^{\rm{d}}}\end{array}\)
\( \Rightarrow \)\(\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}} = \frac{{{{{\rm{(C)}}}^{\rm{c}}}{{{\rm{(D)}}}^{\rm{d}}}}}{{{{{\rm{(A)}}}^{\rm{a}}}{{{\rm{(B)}}}^{\rm{b}}}}}\)

Ở trạng thái cân bằng, vt = vn. Muốn cân bằng chuyển dịch theo chiều thuận thì phải tác động để vt > vn . Chỉ có (1), (2) thỏa mãn.
Chọn đáp án A

4.
a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
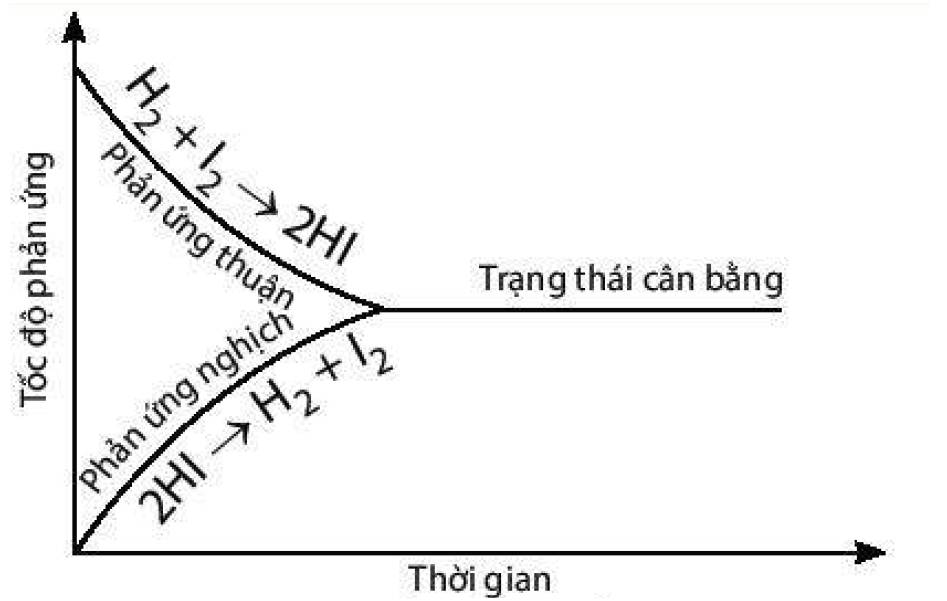
b) Thời điểm phản ứng trên bắt đầu đạt trạng thái cân bằng là thời điểm tốc độ phản ứng thuận bắt đầu bằng tốc độ phản ứng nghịch.
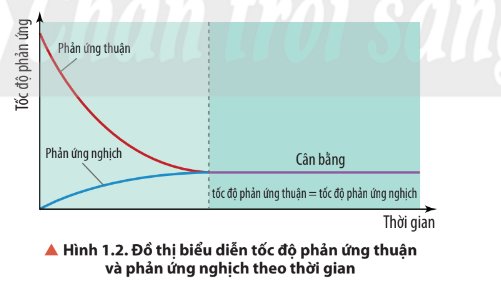
5. Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất không thay đồi.

- Ban đầu:
+ Tốc độ phản ứng thuận giảm dần;
+ Tốc độ phản ứng nghịch tăng dần;
- Đến thời điểm cân bằng: Tốc độ phản ứng thuận = tốc độ phản ứng nghịch.

Chọn đáp án D.
Giảm thể tích, hay tăng áp suất làm tốc độ phản ứng tăng, cả vt và vn đều tăng (cân bằng chuyển dịch theo chiều thuận, vt tăng nhanh hơn vn).

Giảm thể tích, hay tăng áp suất làm tốc độ phản ứng tăng, cả vt và vn đều tăng (cân bằng chuyển dịch theo chiều thuận, vt tăng nhanh hơn vn).
Chọn đáp án D

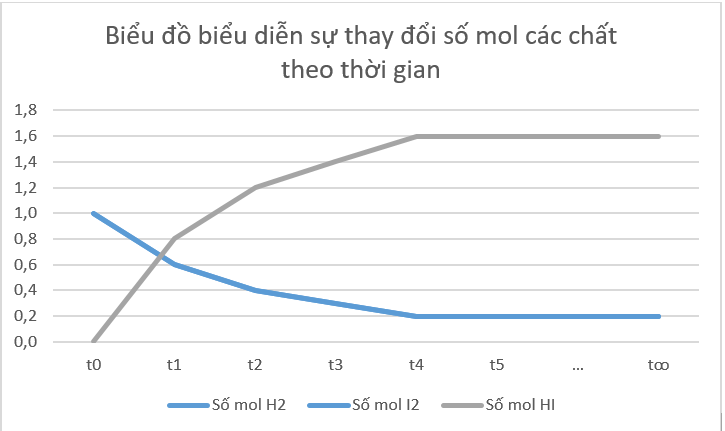
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận:
vthuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\)
- Đối với phản ứng nghịch:
vnghịch = \({\rm{k'}}{\rm{.C}}_{{\rm{HI}}}^2\)
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa.

a)Tại tđ cân bằng:
\(\left[N_2\right]=0,5-\dfrac{1}{2}.0,1=0,5-0,05=0,45\left(M\right)\)
\(\left[H_2\right]=0,6-\dfrac{3}{2}.0,1=0,6-0,15=0,45\left(M\right)\)
\(\Rightarrow k_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,1^2}{0,45.0,45^3}\approx0,244\)
b) Để tăng H tổng hợp \(NH_3\), chúng ta có thể:
- Tăng P bằng cách giảm V (chọn P phù hợp)
- Giảm nhiệt độ của hệ ( chọn nhiệt độ phù hợp)
- Thêm \(N_2;H_2\)
Phát biểu sai: C
Khi phản ứng thuận nghịch đạt trạng thái cân bằng, nồng độ mol của chất phản ứng và các chất sản phẩm không đổi. Tùy thuộc vào hệ số tỉ lượng của phương trình phản ứng và thời điểm đạt trạng thái cân bằng, không phải lúc nồng độ mol của chất phản ứng cũng bằng nồng độ mol của chất sản phẩm phản ứng.