Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
(a) Khí Cl2 và khí O2.
Không xảy ra phản ứng kể cả ở nhiệt độ cao.
(b) Khí H2S và khí SO2.
Có xảy ra phản ứng : ![]()
(c) Khí H2S và dung dịch Pb(NO3)2.
Có xảy ra phản ứng : ![]()
(d) CuS và dung dịch HCl.
Không xảy ra phản ứng
(e) Khí Cl2 và NaOH trong dung dịch.
Có xảy ra phản ứng :
![]()

HCl, H2S, SO2 đều có tính khử nên có thể làm mất màu dung dịch KMnO4, SO3 chỉ có tính oxi hóa nên không làm mất màu được

Chọn đáp án C
1. Bán kính của S lớn hơn bán kính F. Chuẩn
2. Tính khử và tính oxi hóa của HBr đều mạnh hơn HF. Sai tính oxh của HF max
3. Có 2 HX ( X: halogen ) có thể điều chế bằng cách cho NaX tác dụng với dung dịch H2SO4 đậm đặc.
Chuẩn đó là HCl và HF (HI và HBr không điều chế được vì phản ứng với H2SO4 đậm đặc)
4. Tính khử của I- mạnh hơn F-. Chuẩn
5. Trong công nghiệp, người ta không sản xuất các khí SO2, H2S.Chuẩn
6. Tất cả các halogen đều không có ở dạng đơn chất trong thiên nhiên. Chuẩn
7. Để thu được dung dịch H2SO4, trong công nghiệp, người ta cho nước vào oleum
Sai.Phải cho ngươc lại (oleum vào nước)

Chọn đáp án C
(1) (Sai vì tính axit là tính khử khi tính oxi hóa mạnh thì tính khử yếu)
(2) Đ
(3) Đ
(4) Đ
(5) Đ

Câu 1:
a, Hiện tượng: dung dịch Brom nhạt màu dần
- PTHH: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
b, Hiện tượng: Xuất hiện kết tủa màu đen
- PTHH: H2S + Pb(NO3)2 → PbS + 2HNO3
c, Hiện tượng : Bị vẫn đục màu vàng
- PTHH: 2H2S + O2 → S + 2H2O
d, Hiện tượng: Xuất hiện kết tủa trắng
PTHH: H2SO4 + Ba(NO3)2 → BaSO4 + 2HNO3
Câu 2:
a) SO2 + 2H2S \(\underrightarrow{^{t^o}}\)3S + 2H2O
b) H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
c) Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
d) O3 +2 Ag → Ag2O + O2
e) S + O2 \(\underrightarrow{^{t^o}}\) SO2
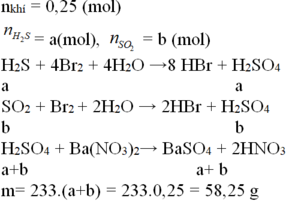
Đáp án D.
H2S + Cu(NO3)2 → CuS + 2HNO3