Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)

a) Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: (x+ 3/2y) mol
Số mol tăng là: (x+ 3/2y) - (x +y) = 0,5y.
b) Ta có; 0,5y ứng với 2% nên y ứng với 4%
vậy O3 chiếm 4%, O2 chiên 96%.

Trong các phản ứng trên chỉ có phản ứng C là phản ứng oxi hoá – khử vì có sự thay đổi số oxi hoá của các nguyên tố.

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

Đáp án đúng: D. 2NH3 + H2O2 + MnS04 —> Mn02 + (NH4)2SO4.

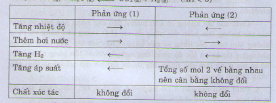
với yếu tố nhiệt độ thì giảm nhiệt độ vì đây là phản ứng tỏa nhiệt vì giảm nhiệt độ phản ưng chuyển dịch theo chiều tỏa nhiệt
với áp suất : tăng áp suất vì vế trái có 4 phân tử khí vế phải có 2 phân tử khí khi tăng áp suất là chuyển dịch theo chiều giảm số phân tử khí
tăng nồng độ N2 hoặc H2 hoặc tăng cả hai vì khi làm như vậy tốc độ phản ứng sẽ xảy ra theo chiều làmtăng nộng độ chất đó

Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào không phải là phản ứng oxi hoá - khử ?
Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng A không phải là phản ứng oxi hoá - khử
Vì trong A các nguyên tố không thay đổi số oxh trước và sau phản ứng!!

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g
.jpg)
Đáp án A
Đây là phản ứng tỏa nhiệt.
Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt hay cân bằng sẽ chuyển dịch theo chiều nghịch do đó làm giảm hiệu suất tổng hợp amoniac
Chọn A