Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

(5): Nhiệt độ; (6): H2, t0 hoặc C, CO; (7): khí clo, t0 hoặc dung dịch muối của kim loại hoạt động kém hơn Cu, hoặc HCl và O2.
Sau đó, lập pthh tương ứng.
4NO2+2H2O+O2=>4HNO3
2HNO3+CuO=>Cu(NO3)2+H2O
Cu(NO3)2+2NaOH=>Cu(OH)2+2NaNO3
Cu(OH)2+2HNO3=>Cu(NO3)2+2H2O
2Cu(NO3)2=>2CuO+ 2NO2+ 3O2
CuO+H2=>Cu+H2O
Cu+HCl=>CuCl2
NO2 => HNO3 => Cu(NO3)2 => Cu(OH)2 => Cu(NO3)2 => CuO => Cu => CuCl2
1. 1H2 + 2NO2 = HNO2 + HNO3
2. 2CuO + 2HNO3 = Cu(NO3)2 + H2O
3. 3Cu(NO3)2 + 2NaOH(dung dịch pha loãng) = Cu(OH)2↓ + 2NaNO3
4. 42HNO3(dung dịch pha loãng) + Cu(OH)2 = Cu(NO3)2 + 2H2O
5. 52Cu(NO3)2 = 2CuO + 4NO2 + O2 Điều kiện: trên 170°C
6. 6CuO + H2 = Cu + H2O Điều kiện: 150—250°C
7. 7Cu + Cl2(ẩm) = CuCl2 Điều kiện: Ở nhiệt độ phòng

Giải thích: Đáp án A
![]()
=> Mg có số oxi hóa tăng sau phản ứng => quá trình oxi hóa Mg là: Mg → Mg2+ + 2e.

Chọn đáp án D.
![]()
(a) Không xảy ra phản ứng.
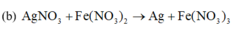
![]()
![]()
![]()
![]()
![]()
![]()
Các thí nghiệm không tạo thành kim loại là: (a), (b), (d), (h).

Đáp án B
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
⇔ PT ion là: Mg(OH)2 + 2H+ + 2Cl– → Mg2+ + 2Cl– + 2H2O.
⇒ PT ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.

Đáp án B
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
Û PT ion là: Mg(OH)2 + 2H+ + 2Cl– → Mg2+ + 2Cl– + 2H2O.
⇒ PT ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
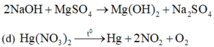
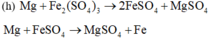
D. Mg chỉ phản ứng với nước nóng mới thu được phương trình như thế này