Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

mAgNO3=500*4/100=20g
mAgNO3giảm=20*68/100=17g
=>nAgNO3=17/170=0.1 mol
PTHH: Cu + 2AgNO3 ------> Cu(NO3)2 + 2Ag
0.05 0.1 0.05 0.1
mCu = 0.05*64=3,2g
mAg =0.1*108= 10,8g
=>khối lượng vật là 5 + 10,8 - 3,2 = 12,6 g
b) từ từ anh làm nhé!!@
nAgNO3 = \(\frac{500.4\%}{170}\) = 2/17 mol
nCu = 0,078125 mol
Cu + 2AgNO3 => Cu(NO3)2 + 2Ag
0,05 <----0,1---------0,05-------> 0,1
m AgNO3 giảm = mAgNO3 pư = 2/17 . 85% = 0,1 mol
ta có m kim loại tăng = 0,05( 216-64) = 7,6
=> m vật = 5+ 7,6 = 12,6 (g)
nAgNO3 dư = \(\frac{2}{17}\) - 0,1 = \(\frac{3}{170}\)
mdd = 5+ 500 - 12,6 = 492,4
C% AgNO3 dư = \(\frac{\frac{3}{170}.170}{492,4}\) .100% = 0,609%
C% Cu(NO3)2 = \(\frac{0,05.188}{492,4}\) .100% = 1,9%

bài 3
Cu +2 AgNO3 -> Cu(NO3)2 + 2Ag
x...............2x.................................2x (mol)
theo bài ta có : 216x-64x=152x=2,28
==> x=0,015 (mol)=> n AgNO3=2x=0,03
==> CMAgNO3 =\(\dfrac{0,03}{\dfrac{30}{1000}}=1\left(M\right)\)
vậy............
bài 1
Zn + CuSO4 -> ZnSO4 + Cu
x x x (mol)
theo bài có 161x-160x=0,2==> x=0,2 = nZn
==> mZn tham gia = 0,2.65=13 (g)
vậy.........

C đúng
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước vì có sự biến đổi electron lớp ngoài cùng của nguyên tử các nguyên tố chu kì sau giống như chu kì trước khi điện tích hạt nhân tăng dần.

Giả sử loại đá vôi ban đầu nặng 100g
=> mCaCO3 = 95g ; mMgCO3 =1,28 g ; m tạp chất trơ = 3,72 gam
=> nCaCO3 = \(\dfrac{95}{100}\)=0,95 mol; nMgCO3 = \(\dfrac{1,28}{24}=0,015\left(mol\right)\)mol
Khi nung thì xảy ra phản ứng:
CaCO3 ––(t°)––> CaO + CO2 ↑
MgCO3 ––(t°)––> MgO + CO2 ↑
Ta có: nCO2 = 0,95+0,015=0,965cmol
Nếu đá vôi bị phân hủy hoàn toàn thì khối lượng giảm:
0,965.44=42,46g
Vì khối lượng chất rắn thu được giảm 40,22%
=> m giảm =100.44,22%= 40,22g
Vậy tỉ lệ đá vôi bị phân hủy là \(\dfrac{40,22}{42,46}.100=94,72\%\)

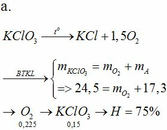
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

a) nNaOH= 0,4 mol
nFe2(SO4)3 = 0,02 mol
nAl2(SO4)3 = 0,04 mol
PTHH
Fe2(SO4)3 + 6NaOH -> 2Fe(OH)3 + 3Na2SO4 (1)
0,02---------> 0,12----------> 0,04
Al2(SO4)3 + 6NaOH -> 2 Al(OH)3 + 3 Na2SO4 (2)
0,04-----------> 0,24------> 0,08
Al(OH)3 + NaOH -> NaAlO2 + 2H2O (3)
0,04<-------0,04------> 0,04
nNaOH(3) = 0,4-0,12-0,24= 0,04
2Fe(OH)3 -> Fe2O3 + 3H2O (4)
0,04----------> 0,02
2Al(OH)3 -> Al2O3 + H2O (5)
0,04-----------> 0,02
nAl2O3 (5) = 0,08 - 0,04= 0,04
Có số mol tự tính khối lượng
b) CM NaAlO2 = \(\frac{0,04}{0,4+0,16}=\frac{1}{14}\)
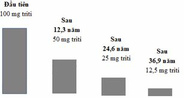
Chu kì phân rã của triti là 12,3 năm. Tức sau 12,3 năm thì một nửa lượng triti bị phân rã
=> Sau 61,5 năm = 5 chu kì bán rã
=> sau 61,5 năm thì lượng triti còn lại là 3,125 mg
Vậy sau 61,5 năm lượng triti còn lại là 3,125 mg.