Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

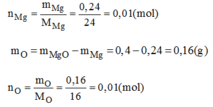
Vậy trong 1 phân tử hợp chất có 0,01 mol nguyên tử Mg; 0,01 mol nguyên tử O. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử O.
→ Công thức hóa học đơn giản của magie oxit là: MgO.

a, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
b, Ta có: \(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{Mg}=0,15\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,15.40=6\left(g\right)\)
Số mol của magie:
\(n_{Mg}=\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
a) \(CTHH:\) \(MgO\)
b) Số mol của magie oxit:
\(n_{MgO}=\dfrac{0,15.2}{2}=0,15\left(mol\right)\)
Khối lượng của magie oxit:
\(m_{MgO}=n_{MgO}.M_{MgO}=0,15.40=6\left(g\right)\)

2Mg + O2 ---> 2MgO
n(MgO) = n(Mg) = 9,6/24 = 0,4 mol.
m(MgO) = 0,4.40 = 16 g.
Vậy chọn C
Bảo toàn KL: \(m_{MgO}=m_{Mg}+m_{O_2}=9,6+6,4=16(g)\)
Chọn C

\(1,PTHH:2Mg+O_2\xrightarrow{t^o}2MgO\\ 2,m_{Mg}+m_{O_2}=m_{MgO}\\ 3,m_{O_2}=15-9=6(g)\)

nMg = 5,76/24 = 0,24 (mol)
PTHH: 2Mg + O2 -> (t°) 2MgO
nMgO = 0,24 (mol)
mMgO = 0,24 . 40 = 9,6 (g)
nMg = 5,76 : 24 = 0,24 ( mol )
pthh : 2Mg+ O2 -t--> 2MgO
0,24->0,12-->0,24 (mol)
=> m = mMgO = 0,24 . 40 = 9,6 (g)

a) 2Mg + O2 --to--> 2MgO
b) \(m_{MgO}=2,4.1,667=4\left(g\right)\)
Theo ĐLBTKL: mMg + mO2 = mMgO
=> mO2 = 4-2,4 = 1,6(g)

Ta có PTHH :
2Mg + O2 -----> 2MgO
Theo định luật bảo toàn khối lượng ta có :
mMg + mO2 = mMgO
=> mO2 = mMgO - mMg
=> mO2 = 15g - 9g = 6g
Vậy khối lượng O2 tham gia phản ứng là 6g

Ta có PTHH :
2Mg + O2 -----> 2MgO
Theo định luật bảo toàn khối lượng ta có :
mMg + mO2 = mMgO
=> mO2 = mMgO - mMg
=> mO2 = 15g - 9g = 6g
Vậy khối lượng O2 tham gia phản ứng là 6g