Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\\ a,\%m_{Fe}=\dfrac{0,02.56}{4,36}.100\approx25,688\%\\ \Rightarrow\%m_{Ag}\approx74,312\%\\ b,Ta.thấy:2,18=\dfrac{1}{2}.4,36\\ \Rightarrow m_{hh\left(câuB\right)}=\dfrac{1}{2}.m_{hh\left(câuA\right)}\\ n_{Fe}=\dfrac{0,02}{2}=0,01\left(mol\right)\\ n_{Ag}=\dfrac{2,18-0,01.56}{108}=0,015\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ 2Ag+Cl_2\rightarrow\left(t^o\right)2AgCl\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+\dfrac{1}{2}.n_{Ag}=\dfrac{3}{2}.0,01+\dfrac{1}{2}.0,015=0,0225\left(mol\right)\\ \Rightarrow V_{Cl_2\left(đktc\right)}=0,0225.22,4=0,504\left(l\right)\)

Bạn xem câu trả lời của mình nha :
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
a ơi nhưng trong đề của cô e cho 4 đáp án không có đáp án 63,15%

Đáp án B
Fe là kim loại yếu hơn Al =>Al phản ứng trước, Fe phản ứng sau => 2,4 gam kim loại chính là Fe dư
Gọi số mol các chất là Al: a mol; Fe (pứ): b mol
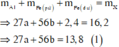
KMnO4 là chất oxi hoá mạnh, trong môi trường axit sẽ oxi hoá Fe + 2 lên Fe + 3 , Cl - 1 lên Cl 2 0 và bản thân Mn + 7 bị khử xuống Mn + 2
Như vậy, khi xét cả quá trình thì chỉ có Al, Fe và KMnO4 thay đổi số oxi hoá:
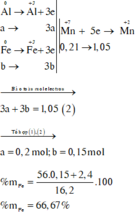

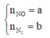

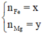
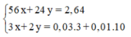
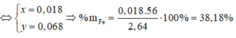
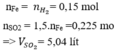
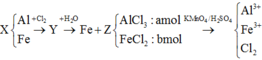
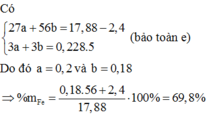
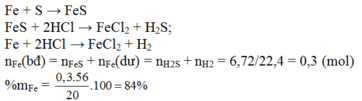
Ta có: nKMnO4 = 4,97.10-4 (mol)
BT e, có: nFeSO4 = 5nKMnO4
⇒ nFeSO4 = 9,94.10-5 (mol) = nFe
\(\Rightarrow\%Fe=\dfrac{9,94.10^{-5}.56}{0,14}.100\%\approx3,976\%\)