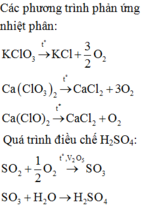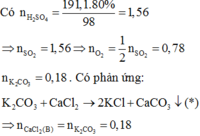Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,27}{22,4}\simeq0,28\)
PTHH: 2KMnO4 --t--> \(K_2MnO_4+MnO_2+O_2\)
Vậy: ----0,56mol--------------------------------------0,28 mol
Khối lượng KMnO4 phản ứng là:
\(m=M.n=0,56.197=110,32\)
Khối lượng KMnO4 ần để phản ứng là:
\(m_{KMnO_4}=m:80\%=137,9\)

a) Giả sử lấy lượng mỗi chất là a gam
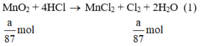
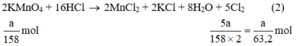
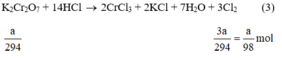
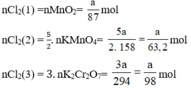
Ta có: 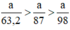
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 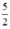 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

a)
nKMnO4 = 47.4/158 = 0.3 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.3_________________________0.15
VO2 = 0.15*22.4 = 3.36 (l)
b)
nKMnO4 = 31.6/158 = 0.2 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.2_________________________0.1
VO2 = 0.1*22.4 = 2.24 (l)
c)
nKMnO4 = 39.5/158 = 0.25 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.25_________________________0.125
VO2 = 0.125*22.4 = 2.8 (l)
2)
a)
nO2 = 3.36/22.4 = 0.15 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.3_________________________0.15
mKMnO4 = 0.3*158 = 47.4(g)
b)
nO2 = 8.96/22.4 = 0.4 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.8_________________________0.4
mKMnO4 = 0.8*158 = 126.4(g)
c)
nO2 = 14.4/32 = 0.45 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.9_________________________0.45
mKMnO4 = 0.9*158 = 142.2(g)

\(n_{Cl_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH: \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
0,04<-----------------------------------------------0,1
\(\Rightarrow n_{KMnO_4\left(c\text{ần}.d\text{ùng}\right)}=\dfrac{0,04}{80\%}=0,05\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,05.158=7,9\left(g\right)\)
PT: \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
Ta có: \(n_{Cl_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
Theo PT: \(n_{KMnO_4\left(LT\right)}=\dfrac{2}{5}n_{Cl_2}=0,04\left(mol\right)\)
Mà: H% = 80% \(\Rightarrow n_{KMnO_4\left(TT\right)}=\dfrac{0,04}{80\%}=0,05\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,05.158=7,9\left(g\right)\)

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
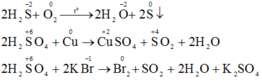

Trong công nghiệp không dùng phản ứng oxi hóa – khử giữa các hóa chất để điều chế clo vì giá thành sản phẩm rất cao.

Ta có nCl2 = 8,96/22,4 = 0,4 mol
PTHH :
2KMnO4 + 16HCl - > 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,16mol.........1,28mol...............................0,4mol
=> Khối lượng của KMnO4 là : mKMnO4 = 0,16.158=25,28(g)
Khối lượng dd HCl là : mddHCl = \(\frac{1,28.36,5.100}{19,2}\approx243,33\left(g\right)\)
Vì hiệu suất là 80% nên
=> \(\left\{{}\begin{matrix}mKMnO4=\frac{25,28.80}{100}=20,224\left(g\right)\\mddHCl=\frac{243,33.80}{100}=194,664\left(g\right)\end{matrix}\right.\)