Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
n N a = 46 23 = 2 m o l , n C l 2 = 71 71 = 1 m o l , m H 2 O = V . D = 10.1 = 10 k g
Nhiệt tỏa ra khi cho 2 mol Na tác dụng với 1 mol C l 2 là:
Q = 98 , 25.2 = 196 , 5 k c a l
Q = m C T 2 − T 1 = 10.1 T 2 − T 1 = 196 , 5 ⇒ T 2 = T 1 = 19 , 65
T 2 = 19 , 65 + 25 = 44 , 65 ° C

\(Q=25\cdot4,2\cdot7=735J\\ \Delta_rH^o_{298}=\dfrac{0,735kJ}{0,025\cdot0,2mol}=147kJ\cdot mol^{-1}\)

a) \(n_{NACl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 (mol)
\(m_{AgCl}=143,5.0,1=14,35g\)
b) \(V_{dd}=300+200=500\left(ml\right)\)
\(C_M\left(NaNO_3\right)=C_M\left(AgNO_3\right)=\frac{0,1}{0,5}=0,2\left(M\right)\)
a)nNaCl=0,1 mol , nAgNO3=0,2 mol
NaCl+AgNO3---->AgCl+NaNO3
theo pt và theo bài ra: NaCl hết, AgNO3 dư 0,1 mol
=> nAgCl=nNaCl=0,1=>mAgCl=14,35 gam.
b) thể tích sau phản ứng=200+300=500 ml= 0,5 lít
Nồng độ CMAgNO3=CMNaNO3=0,1/0,5=0,2.

- Hiện tượng: Chất rắn màu trắng tan ra, tạo thành dung dịch
- Nhiệt độ chất lỏng trong cốc tăng lên, từ 20 oC lên 50 oC
- Giải thích: Sự hòa tan CaO trong nước sinh ra nhiệt, làm nhiệt độ chất lỏng trong cốc tăng lên

nNaCl = = 0,1 mol;
=
= 0,2 mol
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
0,1 mol 0,1 mol 0,1 mol 0,1 mol
mAgCl = 143,5 x 0,1 = 14,35g
b) Vdd = 300 + 200 = 500 ml
= 0,2 - 0,1 = 0,1 mol
=
=
= 0,2 mol/l
\(n_{NaCl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3->AgCl+NaNO_3\) (1)
vì \(\frac{0,1}{1}< \frac{0,2}{1}\) => \(AgNO_3dư\)
theo (1) \(n_{AgCl}=n_{NaCl}=0,1\left(mol\right)\)
=> \(m_{AgCl}=143,5.0,1=14,35\left(g\right)\)
b, 300ml=0,3l , 200ml = 0,2 l
\(V_{dd}=0,3+0,2=0,5\left(l\right)\)
theo (1) \(n_{AgNO_3\left(pư\right)}=n_{NaCl}=0,1\left(mol\right)\)
=> \(n_{AgNO_3\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(C_{M\left(NaNO_3\right)}=\frac{0,1}{0,5}=0,2M\)

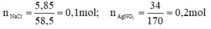
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 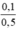 = 0,2 mol/l.
= 0,2 mol/l.


\(Q_{5,03\left(g\right)}=mc\Delta t=100cm^3\cdot0,9969g\cdot cm^{-3}\cdot4,2J\cdot g^{-1}\cdot K^{-1}\cdot\left(34,7-23\right)K\\ Q\approx4900J=4,9kJ\\ Q_{kJ\cdot mol^{-1}}=\dfrac{4,9kJ}{\dfrac{5,03g}{39g\cdot mol^{-1}}}=38kJ\cdot mol^{-1}\)