Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi
\(n_{Na_2CO_3\ pư} = a(mol) ; n_{KHCO_3} = b(mol)\\ Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O\\ KHCO_3 + HCl \to KCl + CO_2 + H_2O\)
Theo PTHH :
\(n_{HCl} = 2a + b = 0,3\\ n_{CO_2} = a + b = 0,18\\ \Rightarrow a = 0,12 ; b = 0,06\)
Hai chất Na2CO3,KHCO3 phản ứng đồng thời với HCl theo cùng 1 tỉ lệ.
Ta có :
\(\dfrac{0,2}{0,2.x} = \dfrac{a}{b} = \dfrac{0,12}{0,06} \Rightarrow x = 0,5\)

Nếu b ≥ 2a thì chắc chắn CO2 sinh ra sẽ như nhau, nhưng đề cho CO2 khác nhau → b < 2a hay a > 0,5b
→ Loại C, D
Thí nghiệm 1: Cho H+ vào CO32-
H+ + CO32- → HCO3-
a a a
H+ + HCO3- → CO2 + H2O
(b – a) → b – a
Thí nghiệm 2: CO32- vào H+
2H+ + CO32- → CO2 + H2O
b → 0,5b
Ta có 0,5b = 2(b – a) → 2a = 1,5b → a = 0,75b
Đáp án A

Đáp án A
Vì thể tích CO2 thu được ở hai lần thí nghiệm khác nhau nên cả hai trường hợp HCl đều hết, chất phản ứng còn lại dư vì nếu ở cả hai trường hợp có các chất đều phản ứng vừa đủ hoặc HCl dư thì lượng CO2 thu được như nhau (bảo toàn nguyên tố C).
Khi cho từ từ từng giọt dung dịch HCl vào dung dịch Na2CO3 có thứ tự các phản ứng xảy ra như sau:
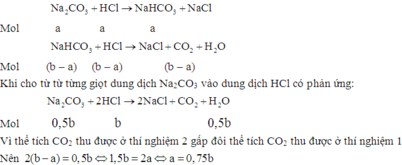

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

Fe_______________________Fe2+
Fe3O4______NaHSO4 0,32 \(\rightarrow\)Fe3+_______+NO 0,04 +H2O
Fe(NO3)2 ________________Na+ 0,32
_________________________SO42- 0,32
_________________________NO3-
_________________________53,92g
Theo bảo toàn H: nNaHSO4=2nH2O=0,32
\(\rightarrow\)nH2O=0,16
Theo bảo toàn khối lượng
m+mNaHSO4=m muối+mNO+mH2O
\(\rightarrow\)m+0,32.120=53,92+0,04.30+0,16.18
\(\rightarrow\)m=19,6

nFe = \(\frac{5,6}{56}\) = 0,1 mol
nCu =\(\frac{3,2}{64}\) = 0,05 mol
nHNO3 = 0,5 . 0,2 = 0,1 mol
nHCl = 0,5 . 0,8 = 0,4 mol
nH+ = nHNO3 + nHCl = 0,5 mol
nCl- = nHCl = 0,4 mol
\(Fe,Cu\underrightarrow{+H^+,NO3^-,Cl^-}Fe^{2+},Cu^{2+},H^+Cl^-\underrightarrow{+Ag^+,NO3^-}\left\{{}\begin{matrix}Fe^{3+},Cu^{2+}\\Ag,AgCl\end{matrix}\right.\)
Fe0 → Fe+3 + 3e.....................4H+ + NO3- + 3e → NO + H2O
0,1________0,3......................0,5__________0,375
Cu0 → Cu+2 + 2e......................................Ag+ + 1e → Ag
0,05_________0,1..............................................x___x
BT e: 0,3 + 0,1 = 0,375 + x
→ x = 0,025
Ag+ + Cl- → AgCl
______0,4____0,4
m↓ = mAg + mAgCl
= 0,025 . 108 + 0,4 . 143,5
= 60,1 (g)
nH+ = nHCl = b mol
nCO3 2- = nNa2CO3 = a mol
Nhỏ HCl vào Na2CO3 thu được lượng khí nhỏ hơn nhỏ Na2CO3 vào HCl nên a < b < 2a
- Nhỏ HCl vào Na2CO3:
H+ + CO3 2- → HCO3-
a_______a______ a
H+ + HCO3 - → CO2 + H2O
b-a_____b-a_____b-a
- Nhỏ Na2CO3 vào HCl:
2H+ + CO3 2- → CO2↑ + H2O
b____b/2________b/2
Tỉ lệ về thể tích chính bằng tỉ lệ về số mol
\(\rightarrow\frac{b-a}{\frac{b}{2}}=\frac{V}{3V}\)
\(\rightarrow\frac{a}{b}=\frac{5}{6}\)