
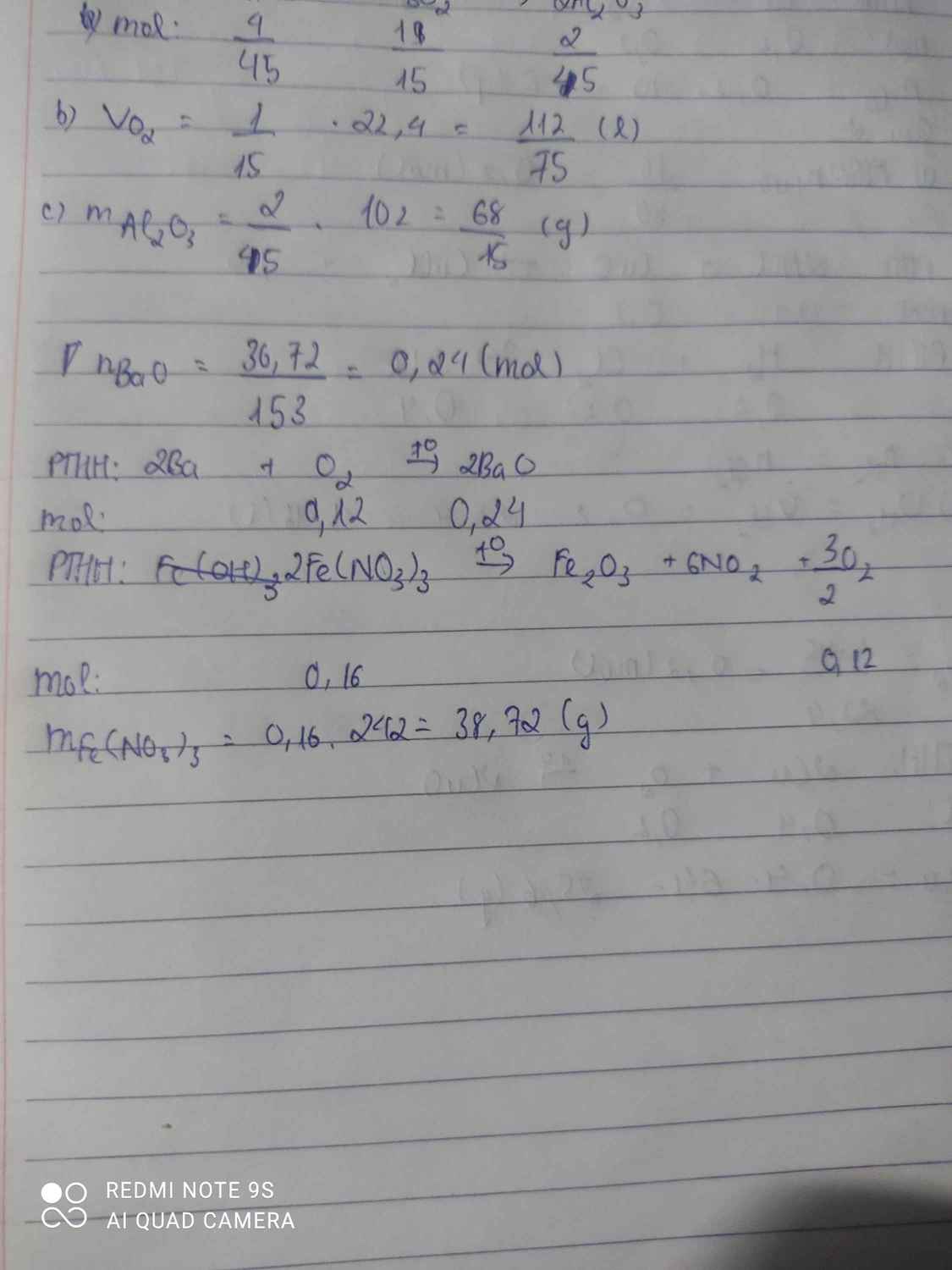
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

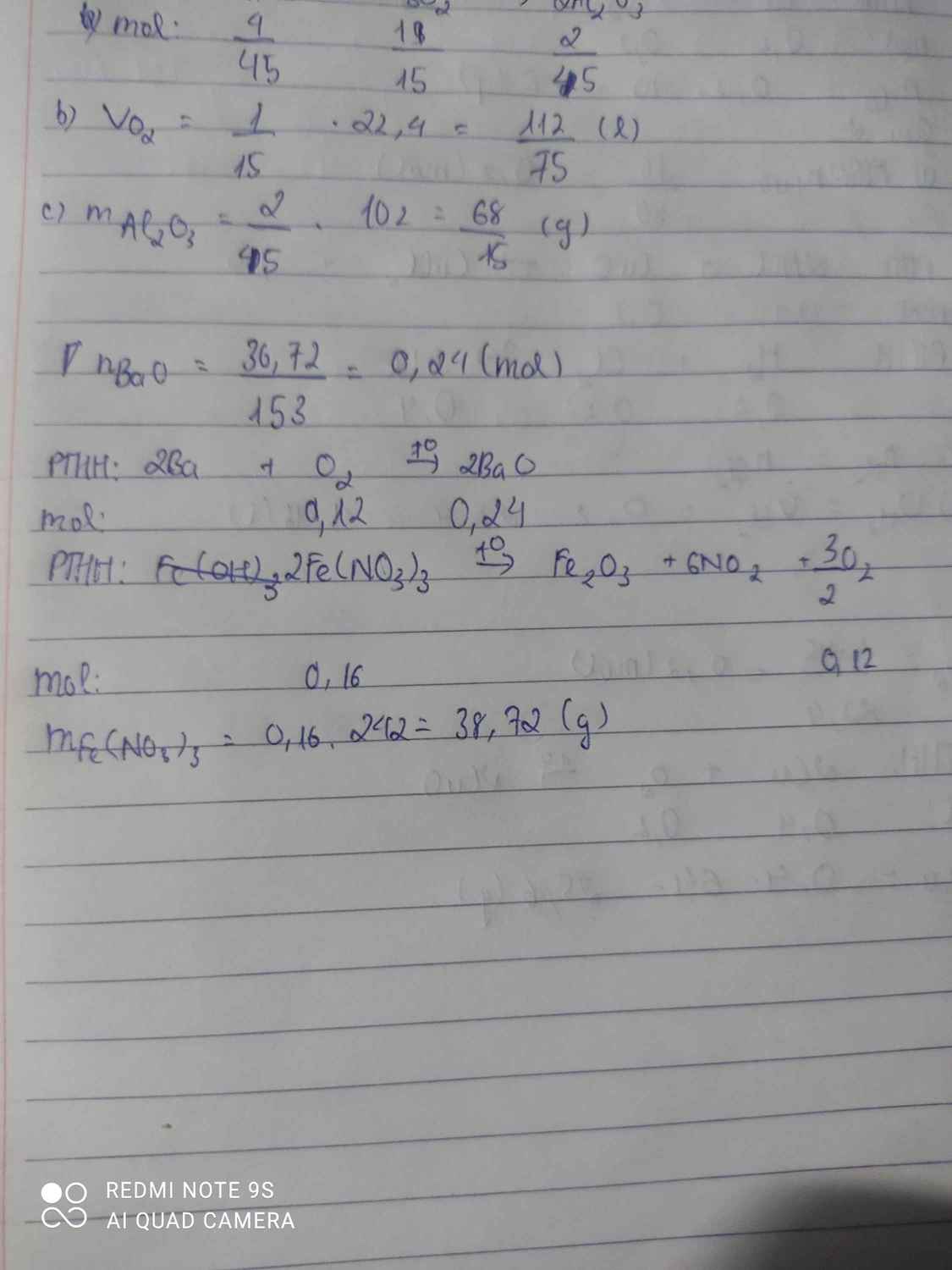

\(n_{Ba}=\dfrac{36,72}{153}=0,24\left(mol\right)\)
PTHH : 2Ba + O2 -> 2BaO
0,24 0,12 0,24
PTHH : 4Fe(NO3)3 \(\underrightarrow{t^0}\) 2Fe2O3 + 12NO2 + 3O2
0,16 0,12
=> \(m_{Fe\left(NO_3\right)_3}=0,16.242=38,72\left(g\right)\)

a) nAl2O3= 5,1/102=0,5(mol)
PTHH: 4Al +3 O2 -to-> 2 Al2O3
nO2= 3/2. nAl2O3= 3/2 . 0,05= 0,075(mol)
=>mO2=0,075 x 32= 2,4(g)
b) 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
nKMnO4= 2.nO2= 2. 0,075= 0,15(mol)
=> mKMnO4= 0,15 x 158= 23,7(g)
nAl2O3 = \(\dfrac{5,1}{102}\)=0,05
PTHH
4Al + 3O2 = 2Al2O3
theo phương trình 4 mol : 3 mol : 2 mol
theo đề bài 0,075mol : 0,05mol
mO2 = 0,075. 32= 2,4g
PTHH
2KMnO4 ➜ K2MnO4 + MnO2 + O2
theo phương trình 2mol : 1mol : 1mol : 1mol
theo đề bài 0,05 mol : 0,075 mol
mKMnO4= 0,05. 158= 7,9g

Ta có : \(n_{Fe2O3}=\frac{m}{M}=\frac{16}{160}=0,1\)
PTHH phản ứng : Fe2O3 + H2 -----> Fe + H2O
=> Cân bằng PTHH : Fe2O3 + 3H2 -----> 2Fe + 3H2O
Tỉ lệ hệ số chất tham 1 : 3 : 2 : 3
gia và sản phẩm 0,1 0,3 0,2 : 0,3
mol mol mol mol
=> VH2 \(=n.22,4=0,3.22,4=6,72\left(l\right)\)
=> mFe = n.M = 0,2 . 56 = 11,2 (g)

10.
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(4Fe+3O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3\)
\(0.3.....0.225....0.15\)
\(V_{O_2}=0.225\cdot22.4=5.04\left(l\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(0.15...........0.45\)
\(m_{H_2SO_4}=0.45\cdot98=44.1\left(g\right)\)
11.
\(n_{Fe_2O_3}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(0.3...........1.8...........0.6\)
\(m_{FeCl_3}=0.6\cdot162.5=97.5\left(g\right)\)
\(m_{HCl}=1.8\cdot36.5=65.7\left(g\right)\)
Bài 10:
\(a,n_{Fe}=\dfrac{16,8}{56}=0,3(mol)\\ PTHH:4Fe+3O_2\xrightarrow{t^o}2Fe_2O_3\\ Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ \Rightarrow n_{O_2}=\dfrac{3}{4}n_{Fe}=0,225(mol)\\ \Rightarrow V_{O_2}=0,225.22,4=5,04(l)\\ b,n_{H_2SO_4}=3n_{Fe_2O_3}=3.\dfrac{1}{2}n_{Fe}=0,45(mol)\\ \Rightarrow m_{H_2SO_4}=0,45.98=44,1(g)\)
Bài 11:
\(a,n_{Fe_2O_3}=\dfrac{48}{160}=0,3(mol)\\ PTHH:Fe_2O_3+6HCl\to 2FeCl_3+3H_2O\\ \Rightarrow n_{FeCl_3}=2n_{Fe_2O_3}=0,6(mol)\\ \Rightarrow m_{FeCl_3}=0,6.162,5=97,5(g)\\ b,n_{HCl}=6n_{Fe_2O_3}=1,8(mol)\\ \Rightarrow m_{HCl}=1,8.36,5=65,7(g)\)

a) 3Fe+2O2-->Fe3O4
n\(_{Fe3O4}=\frac{2,32}{232}=0,01\left(mol\right)\)
Theo pthh
n\(_{Fe}=3n_{Fe3O4}=0,03\left(mol\right)\)
m\(_{Fe}=0,03.56=1,68\left(g\right)\)
Theo pthh
n\(_{O2}=n_{Fe3O4}=0,02\left(mol\right)\)
m\(_{O2}=0,02.32=0,64\left(g\right)\)
b) 2KMnO4--->K2MnO4+MnO2+O2
Theo pthh
n\(_{KMnO4}=2n_{O2}=0,04\left(mol\right)\)
m\(_{KMnO4}=0,04.158=6,32\left(g\right)\)

Em sửa đề là : 56(g) nhé
\(n_{Fe}=\dfrac{56}{56}=1\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(1........\dfrac{2}{3}..........\dfrac{1}{3}\)
\(m_{Fe_3O_4}=\dfrac{1}{3}\cdot232=77.33\left(g\right)\)
\(V_{O_2}=\dfrac{2}{3}\cdot22.4=14.93\left(l\right)\)