Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g

Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
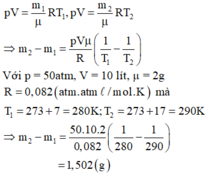

Đáp án: D
Phản ứng xảy ra:
2H2 + O2 → 2H2O.
Theo đó 12g Oxy sẽ kết hợp với 4.12/32 = 1,5g Hidro và thành 13,5 g hơi nước.
Sau phản ứng trong bình có m1 = 3,5g khí hidro và m2 = 13,5g hơi nước.
Lượng nhiệt tỏa ra từ phản ứng là:
Q = Q0.13,5/18 = 1,8.105J.
Lượng nhiệt này sẽ làm tăng nội năng của hơi nước và khí hidro.
Ta có: Q = (c1m1 + c2m2)∆T
![]()
=> Nhiệt độ khí trong bình là
T = T0 + ∆T =2589 K
Vậy áp suất trong bình là:
p = p1 + p2
![]()

Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )

a)
Cứ N A phân tử (nguyên tử) He có khối lượng 4g.
Chú ý: N = 3 , 01.10 23 = N A 2
⇒ khối lượng He trong bình: m = 4 2 = 2 g
b)
Trong điều kiện nhiệt độ và áp suất như trên (ĐKTC),
thể tích của 1 mol He là V 0 = 22,1 lít. Vì lượng khí He
trong bình chỉ là 0,5 mol nên thể tích của bình là:
V = V 0 2 = 11 , 2 lít.

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2

Đáp án A
Phương trình trạng thái ở nhiệt độ T:
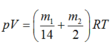
ở nhiệt độ 2T:
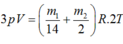
từ đó rút ra: 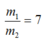
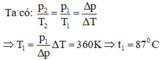
Gọi bán kính của hình cầu là R thì dung tích của bình là
\(V=\frac{4}{3}\pi R^3=1l=10^{-3}m^3\). Suy ra : \(R\approx0,06\)
Diện tích mặt cầu là \(S=4\pi R^2\). Một phân tử khí chiếm diện tích là \(d^2=10^{-20}m^2\)
Số đơn phân tử bám vào thành bình là \(N=\frac{4\pi R^2}{d^2}\). Ở nhiệt độ \(300^oC\), số phân tử ở thành bình sẽ được giải phóng và chiếm toàn bộ dung tích của bình. Vậy mật độ phân tử khí trong bình là :
\(n=\frac{N}{V}=\frac{3}{d^2R}=5.10^{21}m^{-3}\)