Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 7 :
\(n_{H2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
\(\dfrac{8}{15}\) 0,8 \(\dfrac{4}{15}\) 0,8
\(n_{H2SO4}=\dfrac{0,8.3}{3}=0,8\left(mol\right)\)
⇒ \(m_{H2SO4}=0,8.98=78,4\left(g\right)\)
\(n_{Al2\left(SO4\right)3}=\dfrac{0,8.1}{3}=\dfrac{4}{15}\left(mol\right)\)
⇒ \(m_{Al2\left(SO4\right)3}=\dfrac{4}{15}.342=91,2\left(g\right)\)
\(n_{Al}=\dfrac{0,8.2}{3}=\dfrac{8}{15}\left(mol\right)\)
⇒ \(m_{Al}=\dfrac{8}{15}.27=14,4\left(g\right)\)
Chúc bạn học tốt

a)
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH :
$n_{MgCl_2} = n_{H_2} = \dfrac{5,6}{22,4} = 0,25(mol)$
$m_{MgCl_2} = 0,25.95 = 23,75(gam)$
b)
$n_{HCl} = 2n_{H_2} = 0,5(mol)$
$m_{dd\ HCl} = \dfrac{0,5.36,5}{7,3\%} = 250(gam)$
c)
$2K + 2H_2O \to 2KOH + H_2$
$n_K = 2n_{H_2} = 0,5(mol)$
$m_K = 0,5.39 = 19,5(gam)$

\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,5 0,25 0,25
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(a,m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(b,m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{7,3}=250\left(g\right)\)
\(c,2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
0,5 0,25
\(m_K=39.0,5=19,5\left(g\right)\)

a)\(PTHH:Mg+2HCl\xrightarrow[]{}MgCl_2+H_2\)
b) Số mol của magie là:
\(n_{Mg}=\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{3,6}{24}=0,15mol\)
\(PTHH:Mg+2HCl\xrightarrow[]{}MgCl_2+H_2\)
tỉ lệ :1 2 1 1 mol
số mol :0,15 0,3 0,15 0,15 mol
Thể tích khí hiđro là:
\(V_{H_2}=n_{H_2}.22,4=0,15.22,4=3,36\left(l\right)\)
c) Khối lượng muối tạo thành là:
\(m_{MgCl_2}=n_{MgCl_2}.M_{MgCl_2}=0,15.95=14,25\left(g\right)\)
d) Khối lượng axit đã dùng là:
\(m_{HCl}=n_{HCl}.M_{HCl}=0,3.36,5=10,95\left(g\right)\)

Phương trình hóa học của phản ứng:
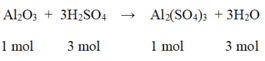
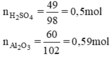
So sánh tỉ lệ 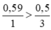 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
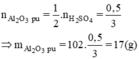
mAl2O3 (dư) = 60 - 17 = 43(g)

\(n_{CO_2}=\dfrac{71,68}{22,4}=3,2\left(mol\right)\)
=> \(m_{CO_2}=3,2.44=140,8\left(g\right)\)
PTHH: CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
3,2<---6,4<-------3,2<----3,2
\(m_{CaCO_3}=3,2.100=320\left(g\right)\)
Số phân tử CaCO3 = 3,2.6.1023 = 19,2.1023 (phân tử)
\(m_{HCl}=6,4.36,5=233,6\left(g\right)\)
Số phân tử HCl = 6,4.6.1023 = 38,4.1023 (phân tử)
\(m_{CaCl_2}=3,2.111=355,2\left(g\right)\)
Số phân tử CaCl2 = 3,2.6.1023 = 19,2.1023 (phân tử)

`a)PTHH:`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`n_[HCl]=0,3.2=0,6(mol)`
Ta có:`[0,4]/1 > [0,6]/2`
`=>Fe` dư
`b)m_[FeCl_2]=0,3.127=38,1(g)`
`c)m_[Fe(dư)]=(0,4-0,3).56=5,6(g)`
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{HCl}=0,3.2=0,6\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Xét: \(\dfrac{0,4}{1}>\dfrac{0,6}{2}\) ( mol )
0,3 0,6 0,3 ( mol )
\(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
\(m_{Fe\left(dư\right)}=\left(0,4-0,3\right).56=5,6\left(g\right)\)

Bài 1 :
Số mol của kẽm oxit
nZnO = \(\dfrac{m_{ZnO}}{M_{ZnO}}=\dfrac{12,15}{81}=0,15\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{5.292}{100}=14,6\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
a) Pt : ZnO + 2HCl → ZnCl2 + H2O\(|\)
1 2 1 1
0,15 0,4 0,15
b) Lập tỉ số so sánh : \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\)
⇒ ZnO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của ZnO
Số mol của kẽm clorua
nZnCl2= \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của kẽm clorua
mZnCl2 = nZnCl2 . MZnCl2
= 0,15 . 136
= 20,4 (g)
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,4 - (0,15. 2)
= 0,1 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư . MHCl
= 0,1. 36,5
= 3,65 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mZnO + mHCl
= 12,15 + 292
= 304,15 (g)
Nồng độ phàn trăm của kẽm clorua
C0/0ZnCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{20,4.100}{304,15}=6,71\)0/0
Nồng độ phần trăm của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{3,65.100}{304,5}=1,2\)0/0
Chúc bạn học tốt
Bài 2 :
Số mol của nhôm oxit
nAl2O3 = \(\dfrac{m_{Al2O3}}{M_{Al2O3}}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{6,3.100}{100}=6,3\left(g\right)\)
Số mol của axit sunfuric
nH2SO4\(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{6,3}{98}=0,06\left(mol\right)\)
a) Pt : Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O\(|\)
1 3 1 3
0,2 0,06 0,02
b) Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,06}{3}\)
⇒ Al2O3 dư , H2SO4 phản ứng hết
⇒ Tính toán dựa vào số mol của H2SO4
Số mol dư của nhôm oxit
ndư = nban đầu - nmol
= 0,2 - \(\left(\dfrac{0,06.1}{3}\right)\)
= 0,18 (mol)
Khối lượng dư của nhôm oxit
mdư = ndư . MAl2O3
= 0,18 . 102
= 18,36 (g)
Số mol của nhôm sunfat
nAl2(SO4)3= \(\dfrac{0,06.1}{3}=0,02\left(mol\right)\)
Khối lượng của nhôm sunfat
mAl2(SO4)3 = nAl2(SO4)3 . MAl2(SO4)3
= 0,02 . 342
= 6,84 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mAl2O3 + mH2SO4
= 20,4 + 100
= 120,4 (g)
Nồng độ phần trăm của nhôm sunfat
C0/0Al2(SO4)3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{6,84.100}{120,4}=5,68\)0/0
Nồng độ phàn trăm của nhôm oxit
C0/0Al2O3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{18,36.100}{120,4}=15,25\)0/0
Chúc bạn học tốt
Ta có nCaO = \(\dfrac{7}{56}\) = 0,125 ( mol )
CaO + 2HNO3 → Ca(NO3)2 + H2O
0,125......0,25...........0,125...........0,125
=> mHNO3 = 63 . 0,25 = 15,75 ( gam )
=> mCa(NO3)2 = 164 . 0,125 = 20,5 ( gam )
PTHH :
CaO(0,125) + 2HNO3(0,25) -----> Ca(NO3)2(0,125) + H2O
Ta có :
nCaO = 7 : 56 = 0,125 (mol)
HNO3 dư
=> nHNO3 (PỨ) = 0,125 . 2 = 0,25 (mol)
=> mHNO3 (PỨ) = 0,25 . (1 + 14 + 48) = 15,75 (g)
nCa(NO3)2 = 0,125 (mol)
=> mCa(NO3)2 = 0,125 . (40 + 28 + 96) = 20,5 (g)
Vậy .........