Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TTĐ:
\(m_{Zn}=6,5\left(g\right)\)
_______________
\(V_{H_2}=?\left(l\right)\)
\(m_{HCl}=?\left(g\right)\)
Giải
Số mol của 6,5 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Tỉ lệ: 1 : 2 : 1 : 1
Số mol: 0,1-> 0,2 : 0,2 : 0,2(mol)
a/ thể tích khí hiđro thu được:
\(V_{H_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
b/ Khối lượng của 0,2 mol HCl:
\(m_{HCl}=n.M=0,2.36,5=7,3\left(g\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
+\(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
+\(nH_2=n_{Zn}=0,5\left(mol\right)\)
+\(n_{HCl}=2n_{Zn}=1\left(mol\right)\)
+\(V_{H2}=0,5.22,4=11,2\left(lit\right)\)
\(m_{HCl}=1.36,5=36,5\left(gam\right)\)
\(n_{Zn}=\dfrac{m}{M}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
\(Zn\) \(+\) \(2\)\(HCl\) → \(ZnCl_2\) \(+\) \(H_2\)
\(0,5\) \(mol\) → \(1\) \(mol\) → \(0,5\)\(mol\) → \(0,5\) \(mol\)
\(V_{H_2}=n.22,4=0,5.22,4=11,2\left(l\right)\)
\(m_{HCl}=n.M=1.36,5=36,4\left(g\right)\)

a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl ---to---> FeCl2 + H2
Mol: 0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
b, \(n_{CuO}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: H2 + CuO ---to---> Cu + H2O
Mol: 0,3 0,3
Ta có: \(\dfrac{0,3}{1}< \dfrac{0,4}{1}\) ⇒ H2 pứ hết, CuO dư
\(m_{Cu}=0,3.64=19,2\left(g\right)\)

a) PTPU

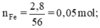
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (l)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)

a.b.
\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,05 0,1 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12l\)
\(m_{HCl}=0,1.36,5=3,65g\)
c.
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,05 0,05 ( mol )
\(m_{Cu}=0,05.64=3,2g\)

a) PTHH: \(Zn+2HCl->ZnCl_2+H_2\)
b) Theo ĐLBTKL: \(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\\)
Hình như đề thiếu thì phải, nếu chỉ cho mZn thì không tính đc k/l axit clohidric cũng như tính thể tích H2. Bạn xem lại đề nha :D
số mol Zn: nZn = 26/ 65 = 0.4
a, pthh: Zn + 2HCL -> ZnCl2 + H2
theo pt: 1mol 2 mol 1mol 1mol
theo đề: 0,4 -> 0.8 -> 0.4 -> 0.4
b, khối lượng axit clohiđric tham gia pư là:
mHCl = nHCl . MHCl
= 0,4 . 36,5 = 14,6 (g)
c, Thể tích H2 thu được ở đktc là:
VH2 đktc = nH2 . 22.4
= 0.4 . 22,4 = 8,96 (lít)

2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----------------------------------0,3
n Al=0,2 mol
=>VH2=0,3.22,4=6,72l
b)
XO+H2-to>X+H2O
0,3-------------0,3
=>0,3=\(\dfrac{19,5}{X}\)
=>X là Zn( kẽm)
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_X=\dfrac{19,5}{M_X}\)
\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(\dfrac{19,5}{M_X}\) \(\dfrac{19,5}{M_X}\) ( mol )
Ta có:
\(\dfrac{19,5}{M_X}=0,3\)
\(\Leftrightarrow M_X=65\)
=> X là kẽm (Zn)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(C_{HCl}=\dfrac{14,6.100}{100}=14,6\)0/0
b) \(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
\(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
c) \(n_{HCl}=\dfrac{36,5}{36,5}=1\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 1 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{1}{2}\)
⇒ Zn phản ứng hết , Hcl dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(n_{HCl\left(dư\right)}=1-\left(0,2.2\right)=0,6\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,6.36,5=14,6\left(g\right)\)
Chúc bạn học tốt
a, Ta có: nZn=\(\dfrac{13}{65}\)=0,2 mol
Zn + 2HCl ---> ZnCl2 + H2
Ta có: nZn=\(\dfrac{1}{2}\)nHCl => nHCl=0,1 mol
=> mHCl=0,1.36,5=3,65 g
=> a%=\(\dfrac{3,65.100}{100}\)=3,65%
b, Ta có: nZn=nZnCl2 = nH2= 0,2 mol
=> VH2=0,2.22,4=4,48 l
=> mZnCl2=0,2.136=27,2 g
c, Zn + 2HCl ---> ZnCl2 + H2
Ta có: nHCl=\(\dfrac{36.5}{36.5}\)=1 mol
Ta có: \(\dfrac{n_{HCl}}{n_{Zn}}=\dfrac{1}{0,2}\) => HCl dư tính theo Zn
Ta có: nZn=nZnCl2 = nH2= 0,2 mol
=> VH2=0,2.22,4=4,48 l
=> mZnCl2=0,2.136=27,2 g
\(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
a, \(n_{H_2}=n_{Mg}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
b, \(n_{HCl}=2n_{Mg}=0,3\left(mol\right)\Rightarrow m_{HCl}=0,3.36,5=10,95\left(g\right)\)
a) số mol của 3,6 gam Mg:
\(n_{Mg}=\dfrac{m}{M}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
1 : 2 : 1 : 1 (mol)
0,15->0,3 : 0,15 : 0,15 (mol)
Thể tích của 0,15 mol H2:
\(V_{H_2}=n.22,4=0,15.22,4=3,36\left(l\right)\)
b) khối lượng của 0,3 mol HCl:
\(m_{HCl}=n.M=0,3.36,5=10,95\left(g\right)\)