Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y<37.2
-> x+y< xấp xỉ 0.6(mol)
Mà theo đề bài,nH2SO4=1(mol)
->hỗn hợp tan hết,axit dư
Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y>37.2
-> x+y>xấp xỉ 0.6(mol)
56x+56y<37.2
->x+y<0.7
->0.6<x+y<0.7
mà nH2SO4 theo đề bài là 1mol
->hỗn hợp tan hết,axit dư ^^ xin lỗi bạn phần trước mình làm sai

Thể tích khí H2: 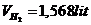

 Số mol
Số mol
Phương trình :



 khối lượng
khối lượng
Vậy khối lượng Mg : 
Vậy khối lượng Cu: 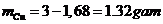

Số mol
Phương trình :

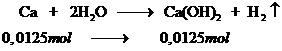
Số mol Ca(OH)2 tạo thành
Thể tích dd :
Nồng độ dd Ca(OH)2

Bài I
1. Lập công thức hoá học của :
a) Nhôm(III) VÀ oxi: Al2O3
b) Natri và nhóm SO4: Na2SO4
c) Bari và nhóm OH: Ba(OH)2
2. Tính phân tử khối của NaOH và FeCl3
+) PTKNaOH = 23 + 16 + 1 = 40đvC
+) PTKFeCl3 = 56 + 3 x 35,5 = 162,5 đvC
Bài II:
1. Tính số mol của 11,2 gam sắt.
=> nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
2. Tính số mol của 1,12 lít khí hiđro(đktc)
=> nH2 = \(\frac{1,12}{22,4}=0,05\left(mol\right)\)
3. Tìm khối lượng của 4,8 lít CO2 (đktc)
=> nCO2 = \(\frac{4,8}{22,4}=\frac{3}{14}\left(mol\right)\)
=> mCO2 = \(\frac{3}{14}.44=9,43\left(gam\right)\)
4. Tìm số mol của 11,1 gam CaCl2
=> ncaCl2 = \(\frac{11,1}{111}=0,1\left(mol\right)\)
Bài III
1. PTHH: Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O
2. Ta có: nFe = \(\frac{16}{160}=0,1\left(mol\right)\)
a) Theo phương trình, nH2 = 0,1 x 3 = 0,3 (mol)
=> VH2(đktc) = \(0,3\times22,4=6,72\left(l\right)\)
b) Theo phương trình, nFe = 0,1 x 2 = 0,2 (mol)
=> mFe = 0,2 x 56 = 11,2 (gam)

nMg = \(\dfrac{6}{24}=0,25\left(mol\right)\)
Pt: Mg + 2HCl --> MgCl2 + H2
...0,25........0,5......................0,25
VH2 thu được = 0,25 . 22,4 = 5,6 (lít)
mHCl đã dùng = 0,5 . 36,5 = 18,25 (g)
c) nFe2O3 = \(\dfrac{16}{160}=0,1\left(mol\right)\)
Pt: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
...................0,25 mol--> \(\dfrac{0,5}{3}\) mol
Xét tỉ lệ mol giữa Fe2O3 và H2:
\(\dfrac{0,1}{1}>\dfrac{0,25}{3}\)
Vậy Fe2O3 dư
mFe thu được sau pứ = \(\dfrac{0,5}{3}.56=9,33\left(g\right)\)

Ta có pthh
2Al + 3H2SO4 \(\rightarrow\)Al2(SO4)3 + 3H2
Theo đề bài ta có
nAl=\(\dfrac{10,8}{27}=0,4mol\)
a, Theo pthh
nAl2(SO4)3 =\(\dfrac{1}{2}nAl=\dfrac{1}{2}.0,4=0,2mol\)
\(\Rightarrow\)mAl2(SO4)3=0,2.342=68,4 g
nH2=\(\dfrac{3}{2}nAl=\dfrac{3}{2}.0,4=0,6mol\)
\(\Rightarrow\)VH2=0,6.22,4=13,44 l
b, Khối lượng dd H2SO4 là
mddH2SO4 =\(\dfrac{mct.100\%}{C\%}=\dfrac{10,8.100\%}{10\%}=108g\)
Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 (loãng) -> Al2(SO4)3 + 3H2
Theo PTHH và đề bài, ta có:
\(n_{H_2SO_4}=n_{H_2}=\dfrac{3.n_{Al}}{2}=\dfrac{3.0,4}{2}=0,6\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{n_{Al}}{2}=\dfrac{0,4}{2}=0,2\left(mol\right)\)
a) Khối lượng muối tạo thành sau phản ứng:
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
Thể tích khí H2 thoát ra (đktc):
\(V_{H_2\left(đktc\right)}=0,6.22,4=13,44\left(l\right)\)
b) Khối lượng H2SO4:
\(m_{H_2SO_4}=0,6.98=58,8\left(g\right)\)
Khối lượng dung dịch H2SO4 đã dùng:
\(m_{ddH_2SO_4}=\dfrac{m_{H_2SO_4}.100\%}{C\%_{ddH_2SO_4}}=\dfrac{58,8.100}{10}=588\left(g\right)\)

a)
n H2S04 = 1
n Zn = a
n Fe = b
=> 65a + 56b = 37,2 (*)
Giả sử hỗn hợp chỉ chứa toàn Zn thì ta có:
65a + 56b = 37,2
=> 65(a + b) > 37,2
<=> a + b > 0,57 (1)
Giả sử hỗn hợp toàn Fe thì ta cũng có:
56(a + b) < 37,2
<=> a + b < 0,66 (2)
Zn + H2S04 --> ZnS04 + H2
a........a
Fe + H2S04 --> FeS04 + H2
b.........b
Tổng n H2S04 = a + b = 1 mol
Mà theo 1 và 2 thấy
0,57 < a + b < 0,66
=> chứng tỏ rằng hỗn hợp này tan hết, axit dư
b)
nếu dùng 1 lượng Zn và Fe gấp đôi trường hợp trước
=> 0,57*2 < a + b < 0,66*2
<=> 1,14 < a + b < 1,32
lượng H2SO4 vẫn như cũ vẫn là 1 mol
=> hỗn hợp ko tan hết
c)
n Cu0 = 0,6
n H2 = a + b
H2 + Cu0 --> Cu + H20
a+b..a+b
=> a + b = 0,6 (**)
Từ (*) và (**) ta có hệ:
{65a + 56b = 37,2
{ a + b = 0,6
giải ra được:
a = 0,4
b = 0,2
=> m Zn = 26
m Fe = 11,2

Zn+H2SO4--->ZnSO4+H2
x______x_______x_____x
Fe+H2SO4--->FeSO4+H2
y____y_________y____y
Ta có: 65x+56y=37,2
Giả sự hỗn hợp chỉ chứa toàn Zn
65(x+y)>37,2
=>x+y>0,57(1)
Giả sự hỗn hợp chỉ chứa toàn Fe
56(x+y)<37,2
=>x+y<0,66(2)
Từ (1) và (2) =>0,57<x+y<0,66
Mà theo các pt: nH2SO4=x+y=0,5.2=1(mol)
===>Hỗn hợp tan hết,axit dư
b) Dùng lượng Zn và Fe gấp đôi
Ta có: 1,14<x+y<1,32
Mà H2SO4 vẫn giữu nguyên 1 mol
===>Hỗn hợp k tan hết
c) nCuO=48/80=0,6(mol)
H2+CuO--->Cu+H2O
x+y__x+y
Hệ pt:
\(\left\{{}\begin{matrix}x+y=0,6\\65x+56y=37,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,4\\y=0,2\end{matrix}\right.\)
=>mZn=0,4.65=26(g)
=>mFe=0,2.56=11,2(g)


nZn=m/M=3,25/65=0,05(mol)
PT:
Zn + 2HCl -> ZnCl2 + H2\(\uparrow\)
1........2...............1...........1 (mol)
0,05->0,1 -> 0,05 -> 0,05 (mol)
b) VHCl=n/CM=0,1/0,5=0,2(lít)
ủa mình gửi rồi mà ta