Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

Đổi 300ml = 0,3 lít
Ta có: \(n_{H_2SO_4}=5.0,3=1,5\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{\dfrac{8\%.400}{100\%}}{171}=\dfrac{32}{171}\left(mol\right)\)
a. PTHH: \(Ba\left(OH\right)_2+H_2SO_4--->BaSO_4\downarrow+2H_2O\)
Ta thấy: \(\dfrac{1,5}{1}>\dfrac{\dfrac{32}{171}}{1}\)
Vậy Ba(OH)2 dư, H2SO4 hết.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=1,5\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=1,5.233=349,5\left(g\right)\)
b. Không có muối tạo thành

\(n_{hh}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Do SO2 và O2 tỉ lệ mol 1:1
=> \(n_{SO_2}=n_{O_2}=0,2\left(mol\right)\)
\(2SO_2+O_2-^{t^o,V_2O_5}\rightarrow2SO_3\)
Lập tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,2}{1}\) => Sau phản ứng O2 dư, tính theo số mol của SO2
Theo PT: \(n_{SO_3}=n_{SO_2}=0,2\left(mol\right)\)
Hỗn hợp khí Y gồm SO3, O2
\(SO_3+Ba\left(OH\right)_2\rightarrow BaSO_4\)
\(n_{BaSO_4}=n_{SO_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_{\text{4 }}\left(lt\right)}=0,2.233=46,6\left(g\right)\)
Thực tế chỉ thu được 45,8g kết tủa
\(\Rightarrow H=\dfrac{45,8}{46,6}=98,28\%\)

Bài 1:
400ml dd E chứa \(\left\{{}\begin{matrix}AlCl_3:0,4x\left(mol\right)\\Al_2\left(SO_4\right)_3:0,4y\left(mol\right)\end{matrix}\right.\)
Xét TN2:
\(n_{BaSO_4}=\dfrac{33,552}{233}=0,144\left(mol\right)\)
=> \(n_{Al_2\left(SO_4\right)_3}=\dfrac{0,144}{3}=0,048\left(mol\right)\)
=> y = 0,12
Xét TN1:
\(n_{Al\left(OH\right)_3}=\dfrac{8,424}{78}=0,108\left(mol\right)\)
nNaOH = 0,612.1 = 0,612 (mol)
Do \(3.n_{Al\left(OH\right)_3}< n_{NaOH}\) => Kết tủa bị hòa tan 1 phần
PTHH: Al2(SO4)3 + 6NaOH --> 3Na2SO4 + 2Al(OH)3
0,048------>0,288------------------->0,096
AlCl3 + 3NaOH --> 3NaCl + Al(OH)3
0,4x--->1,2x------------------>0,4x
Al(OH)3 + NaOH --> NaAlO2 + 2H2O
(0,324-1,2x)<-(0,324-1,2x)
=> 0,096 + 0,4x - (0,324-1,2x) = 0,108
=> x = 0,21
=> \(\dfrac{x}{y}=\dfrac{0,21}{0,12}=\dfrac{7}{4}\)
Bài 3:
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{200.1,71\%}{342}=0,01\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
- Nếu kết tủa không bị hòa tan:
PTHH: 6NaOH + Al2(SO4)3 --> 3Na2SO4 + 2Al(OH)3
0,03<-------------------------------0,01
=> \(C_M=\dfrac{0,03}{0,2}=0,15M\)
- Nếu kết tủa bị hòa tan 1 phần
PTHH: 6NaOH + Al2(SO4)3 --> 3Na2SO4 + 2Al(OH)3
0,06<---0,01-------------------------->0,02
Al(OH)3 + NaOH --> NaAlO2 + 2H2O
0,01---->0,01
=> \(C_M=\dfrac{0,06+0,01}{0,2}=0,35M\)

a) 2NaOH+CuSO4--->Cu(OH)2+Na2SO4
Cu(OH)2---->CuO+H2O
b)n\(_{CuSO4}=\frac{256.5\%}{160}=0,08\left(mol\right)\)
=> n\(_{NaOH}=0,16\left(mol\right)\)
m\(ddNaOH=\)\(\frac{0,16.40.100}{4}=160\left(g\right)\)
V\(_{NaOH}=160.1,5=240ml=0,24\left(l\right)\)
Theo pthh
n\(_{Cu\left(OH\right)2}=n_{CuSO4}=0,08\left(mol\right)\)
m\(_{Cu\left(OH\right)2}=0,08.98=7,84\left(g\right)\)
c) mdd sau pư=256+160=416(g)
Theo pthh
n\(_{Na2SO4}=n_{CuSO4}=0,08\left(mol\right)\)
C% Na2SO4=\(\frac{0,08.142}{416}.100\%=2,73\%\)
d) Theo pthh2
n\(_{CuO}=n_{Cu\left(OH\right)2}=0,08\left(mol\right)\)
m\(_{CuO}=0,08.80=6,4\left(g\right)\)
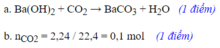
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4 (1)
nCuSO4=0,4(mol)
Theo PTHH 1 ta có:
nNaOH=2nCuSO4=0,8(mol)
nCu(OH)2=nCuSO4=0,4(mol)
CM dd NaOH=\(\dfrac{0,8}{0,2}=4M\)
mCu(OH)2=98.0,4=39,2(g)
Cu(OH)2 -> CuO + H2O (2)
nCuO thực tế=0,1(mol)
Theo PTHH 2 ta có:
nCuO lý thuyết=nCu(OH)2=0,4(mol)
=>H=\(\dfrac{0,1}{0,4}.100\%=25\%\)
\(n_{CuSO_4}=0,2.2=0,4mol\)
CuSO4+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+Na2SO4
\(n_{NaOH}=2n_{CuSO_4}=2.0,4=0,8mol\)
\(C_{M_{NaOH}}=\dfrac{n}{v}=\dfrac{0,8}{0,2}=4M\)
\(n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,4mol\)
\(m_{Cu\left(OH\right)_2}=0,4.98=39,2gam\)
Cu(OH)2\(\overset{t^0}{\rightarrow}\)CuO+H2O
\(n_{Cu\left(OH\right)_2\left(pu\right)}=n_{CuO\left(tt\right)}=\dfrac{m}{M}=\dfrac{8}{80}=0,1mol\)
\(\rightarrow H\)=\(\dfrac{0,1}{0,4}.100=25\%\)