Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) X + HCl \(\rightarrow\) NO
=> trong X còn muối Fe(NO3)2
\(n_{NO\left(1\right)}=\frac{7,84}{22,4}=0,35mol\); \(n_{NO\left(2\right)}=\frac{1,12}{22,4}=0,05\left(mol\right)\)
Sau khi cho HCl vào X thì thu được dung dịch trong đó chứa: Cu2+ và Fe3+
Gọi x, y lần lượt là số mol của Fe và Cu
Ta có:
\(\begin{cases}56x+64y=26,4\\3x+2y=3\left(0,35+0,05\right)\end{cases}\)\(\Leftrightarrow\begin{cases}x=0,3\\y=0,15\end{cases}\)
=> \(\%Fe=\frac{0,3.56}{26,4}.100\%=63,64\%\); %Cu = 100% - %Fe = 36,36%
2) Số mol HNO3 than gia phản ứng = 4nNO(1) = 0,35.4 = 1,4(mol)
3) Gọi a , b lần lượt là số mol Fe(NO3)2 và Fe(NO3)3 trong X
=> a + b = 0,3
2a + 3b + 2. 0,15 = 3.0,35
=> a = 0,15 (mol); b = 0,15 (mol)
=> trong X có : 0,15 mol Fe(NO3)2; 0,15 (mol) Fe(NO3)3 và 0,15 mol Cu(NO3)2
=> CM các chất đều bằng nhau và bằng: \(\frac{0,15}{0,8}=0,1875M\)

Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A

a) Fe+4HNO3--->Fe(NO3)3+NO+2H2O
x---------------------------------------x
3Cu+8HNO3--->3Cu(NO3)2+2NO+4H2O
y----------------------------------2/3y
n NO=4,48/22,4=0,2(mol)
Ta có hệ pt
\(\left\{{}\begin{matrix}64x+56x=15,2\\x+\frac{2}{3}y=0,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,08\\y=0,18\end{matrix}\right.\)
%m Cu=\(\frac{0,08.64}{15,2}.100\%=33,68\%\)
%m Fe=100-33,68=66,32%
b) Theo pthh
n HNO3=2n NO=0,4(mol)
m HNO3=0,4.63=25,,2(g)
Áp dụng định luật bảo toàn ta có
m muối=m kim loại+m HNO3-m NO
=15,2+25,2-(0,2.30)=34,4(g)
nNO=0,2mol
\(\text{3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O}\)
\(\text{Fe+4HNO3→Fe(NO3)3+NO+2H2O}\)
Gọi số mol Cu và Fe là a và b
Ta có 64a +56b=15,2
Theo phương trình \(\text{2nCu+3nNO=3nNO}\)
\(\rightarrow\) 2a+3b=3.0,2
\(\rightarrow\)a=0,15 b=0,1
a. %mCu=\(\frac{\text{0,15.64}}{15,5}\)=63,16%
%mFe=36,84%
b. m=mCu(NO3)2+mFe(NO3)3=\(\text{0,15.188+0,1.242=52,4g}\)

\(n_{NO}=\dfrac{7,84}{22,4}=0,35mol\)
3Cu+8HNO3\(\rightarrow\)3Cu(NO3)2+2NO+4H2O
x........\(\dfrac{8x}{3}\).............x.................\(\dfrac{2x}{3}\)
Fe+4HNO3\(\rightarrow\)Fe(NO3)3+NO+2H2O
y.......4y............y...............y
-Ta có hệ: \(\left\{{}\begin{matrix}64x+56y=23,6\\\dfrac{2x}{3}+y=0,35\end{matrix}\right.\)
Giải ra x=0,15 và y=0,25
%Cu=\(\dfrac{0,15.64.100}{23,6}\approx40,7\%\)
%Fe=59,3%
\(n_{Cu\left(NO_3\right)_2}=0,15mol\)\(\rightarrow\)\(m_{Cu\left(NO_3\right)_2}=0,15.188=28,2gam\)
\(n_{Fe\left(NO_3\right)_3}=0,25mol\rightarrow\)\(m_{Fe\left(NO_3\right)_3}=0,25.242=60,5gam\)
\(m_A=28,2+60,5=88,7gam\)
\(n_{HNO_3}=\dfrac{8x}{3}+4y=\dfrac{8}{3}.0,15+4.0,25=1,4mol\)
\(V_{HNO_3}=\dfrac{1,4}{2}.\dfrac{110}{100}=0,77l\)

Cách 1: Dùng CT và BT điện tích
\(nNO=0,3mol\)
Mà \(nNO_3\) - trong muối \(=3nNO-=0,9mol\)
Muối \(=mKL+mNO_3-\rightarrow mKL=68,25-0,9.62=12,45\)
nFe = x mol , nAl = y mol
Muối bao gồm Fe3+ , Al3+ , NO3-
BTĐT : \(3x+3y=0,9\rightarrow x+y=0,3\)
\(56x+27y=12,45\)
Giải ra \(x=0,15;y=0,15\)
\(mFe=0,15.56=8,4g\)
\(mAl=4,05g\)
Bài này dễ ợt đi
Fe + 4HNO3 -> Fe(NO3)3 + NO + 2H2O (1)
Al + 4HNO3 -> Al(NO3)3 + NO + 2H2O (2)
nNO=0,3(mol)
Đặt nFe=nFe(NO3)3=nNO(1)=a
nAl=nAl(NO3)3=nNO(2)=b
Ta có:
\(\left\{{}\begin{matrix}242a+213b=68,25\\a+b=0,3\end{matrix}\right.\)
=>a=b=0,15
mFe=56.0,15=8,4(g)
mAl=27.0,15=4,05(g)

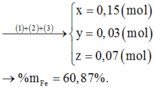
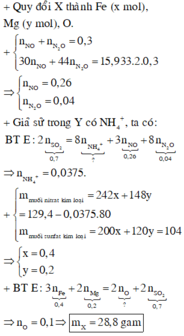

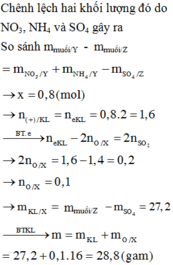
nNO2=\(\frac{1,344}{22,4}\)=0,06
a. Gọi số mol Fe và Cu là a và b ta có
56a+64b=1,52
Lại có theo bảo toàn e
3nFe+2nCu=nNO2\(\rightarrow\)3a+2b=0,06
\(\rightarrow\)a=0,01; b=0,015
\(\rightarrow\)mFe=0,01.56=0,56
\(\rightarrow\)mCu=1,52-0,56=0,96
b. Cô can dung dịch thu được Fe(NO3)3 0,01; Cu(NO3)2 0,015
2Fe(NO3)3\(\rightarrow\)Fe2O3+6NO2+1,5O2
2Cu(NO3)2\(\rightarrow\)2CuO+4NO2+O2
nNO2=3nFe(NO3)3+2nCu(NO3)2=0,06; nO2=0,015
PTHH _____:4NO2+O2+2H2O\(\rightarrow\)4HNO3
Trước________0,06 __0,015
Phản ứng _____0,06___0,015
Sau_________0 ____0__________0,06
\(\rightarrow\)CMHNO3=\(\frac{0,06}{2}\)=0,03
\(\rightarrow\)pH=-log(0,03)=1,52