Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
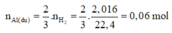
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
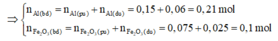
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
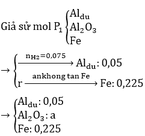
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4

Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
BTNT O, có: \(V_{O\left(trongA\right)}+2V_{O_2}=2V_{CO_2}+V_{H_2O}\Rightarrow V_{O\left(trongA\right)}=0\)
Vậy: A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{n_{CO_2}}{n_A}=3\\y=\dfrac{2n_{H_2O}}{n_A}=8\end{matrix}\right.\)
Vậy: CTPT cần tìm là C3H8

pt N2+3H2--->2NH3
ban đầu 8(l) 25 (l) o
phản ứng x--->3x--->2x
sau 8-x 25-3x 2x
ta có 8-x+25-3x+2x=22,4 ---> x=5,3
từ pt ---> H2 dư nhìu hơn N2 ---> tính H theo N2 ta có 5,3/8=66,25%

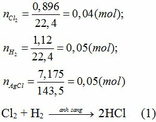
Hỗn hợp sản phẩm gồm: HCl, Cl2 dư, H2 dư. Khi cho phản ứng với AgNO3 chỉ có HCl phản ứng.
HCl + AgNO3 → AgCl + HNO3 (2)
0,05 ← 0,05 (mol)
Từ PTHH (2): nHCl = nAgCl = 0,05 (mol)
Từ PTHH (1): nCl2pư = nH2 pư = ½ nHCl = ½. 0,05 = 0,025 (mol)
Vì nCl2bđ < nH2 => Hiệu suất được tính theo Cl2
Vậy bạn học sinh đã tính đúng hiệu suất phản ứng giữa Cl2 và H2.
Chú ý:
3.Tính hiệu suất theo chất phản ứng hết khi H =100%



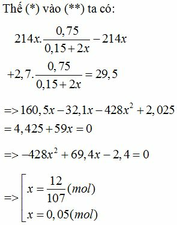
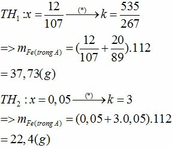
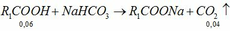
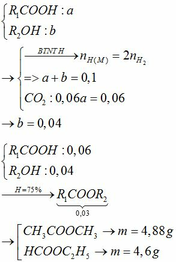
Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích V lít
\(n_{N_2}=\dfrac{12}{V}\left(mol\right)\)
\(n_{H_2}=\dfrac{36}{V}\left(mol\right)\)
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Xét tỉ lệ \(\dfrac{\dfrac{12}{V}}{1}=\dfrac{\dfrac{36}{V}}{3}\) => Hiệu suất có thể tính theo N2 hoặc H2
Gọi số mol N2 pư là a (mol)
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Trc pư: \(\dfrac{12}{V}\) \(\dfrac{36}{V}\) 0
Pư: a---------->3a---------------2a
Sau pư: \(\left(\dfrac{12}{V}-a\right)\) \(\left(\dfrac{36}{V}-3a\right)\) 2a
=> \(n_{hh\left(saupư\right)}=\left(\dfrac{12}{V}-a\right)+\left(\dfrac{36}{V}-3a\right)+2a=\dfrac{37,2}{V}\)
=> \(a=\dfrac{5,4}{V}\left(mol\right)\)
=> \(H\%=\dfrac{\dfrac{5,4}{V}}{\dfrac{12}{V}}.100\%=45\%\)
Điều kiện gì :v?