Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)


→ nH2 = 0,03
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
0,01 ← 0,03
2Al + 6HCl → 2AlCl3 + 3H2↑
→ nH2 = 0,03 → nAl = 0,02
2Al + 3S → Al2S3
Pư: 0,02 0,03 ←0,01
Dư: 0,02 0,00125
Bđ: 0,04 0,03125
=> %Al = 51,92%
%S = 48,08%

\(n_{H_2}=\dfrac{4,928}{22,4}=0,22mol\)
\(n_{CuSO_4}=0,66.0,5=0,33mol\)
- Gọi số mol trong phần I là :Fe(x mol), Al(y mol), Ag(z Mol)
- Sỗ mol mỗi kim loại trong phần II: Fe(tx mol), Al(ty mol), Ag(tz Mol)
56(x+tx)+27(y+ty)+108(z+tz)=24,5(*)
- Phần I: Fe+2HCl\(\rightarrow\)FeCl2+H2(1)
2Al+6HCl\(\rightarrow\)2AlCl3+3H2(2)
x+1,5y=0,22(**)
- Phần II: Fe+CuSO4\(\rightarrow\)FeSO4+Cu(3)
2Al+3CuSO4\(\rightarrow\)Al2(SO4)3+3Cu(4)
tx+1,5ty=0,33(***)
152tx+171ty=39,9(****)
- Kết hợp(***) và(****) : tx=0,06, ty=0,18
\(y=3x\)(*****)
- kết hợp (**) và (*****) ta có: x=0,04, y=0,12
\(\rightarrow t=\dfrac{0,06}{0,04}=1,5\)
- Thay x=0,04 ,y=0,12 , t=1,5 vào (*) ta có z=0,04
mI=56x+27y+108z=56.0,04+27.0,12+108.0,04=9,8 gam
số mol Cu=tx+1,5ty=0,33 mol
chất rắn Z gồm 0,33 mol Cu và tz=0,04.1,5=0,06 mol Ag
mZ=0,33.64+0,06.108=27,6 gam

2Al + 3S —> Al2S3
Chất rắn X gồm Al2S3, Al dư và S dư. Khí gồm H2S và H2. Chất rắn không tan là S dư.
+)Khí với Pb(NO3)2:
H2S + Pb(NO3)2 —> PbS + 2HNO3
0,03………………..……….0,03
n khí = 0,06 —> nH2 = 0,06 – 0,03 = 0,03 (mol)
+) Chất rắn X với HCl dư:
Al2S3 + 6HCl —> 2AlCl3 + 3H2S
0,01…………….....................0,03
2Al + 6HCl —> 2AlCl3 + 3H2
0,02………………………….0,03
+) Nung Al với S:
2Al + 3S —> Al2S3
0,02…0,03…..0,01
mAl = (0,02 + 0,02).27 = 1,08 g
mS = 0,03.32 + 0,04 = 1 g

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
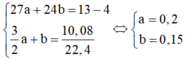
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.
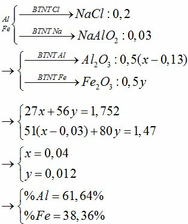
Tham Khảo
Trong mỗi phần chứa Al (a mol), Fe (b mol) và Cu (0,2 gam)
—> 27a + 56b + 0,2 = 1,5/2
và 3a + 2b = 0,02.2
—> a = 0,01 và b = 0,005
mAl = 0.01*27 = 0.27 g
nAgNO3 = 0,032 và nCu(NO3)2 = 0,2
Dễ thấy 0,032 < 0,01.3 + 0,005.2 < 0,032 + 0,2.2 nên Al, Fe, AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần.
Dung dịch B chứa Al(NO3)3 (0,01), Fe(NO3)2 (0,005)
Bảo toàn N —> nCu(NO3)2 dư = (0,032 + 0,2.2 – 0,01.3 – 0,005.2)/2 = 0,196
Chất rắn A chứa Ag (0,032 mol), Cu ban đầu (0,2 gam) và Cu mới sinh (0,2 – 0,196 = 0,004 mol)
mA = 16.512 g
Quang Nhân có thể giải thk phần II đc ko?