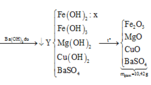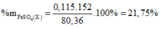Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lượng khí hidro thoát ra là 0,15 mol.
a) Al2O3 + 2NaOH \(\rightarrow\) 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2.
b) Lượng Al phản ứng bằng 2/3 số mol khí hidro thoát ra và bằng 0,1 mol.
\(\Rightarrow\) %mnhôm=\(\dfrac{27.0,1}{12,9}\).100%\(\approx\)20,93%, %mnhôm oxit\(\approx\)100%-20,93%\(\approx\)79,07%.

\(n_{HCl}=0,3.1=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,15 ( mol )
\(m_{Al}=0,1.27=2,7g\)
\(\Rightarrow m_{Al}=9,1.2,7=6,4g\)
\(V_{H_2}=0,15.22,4=3,36l\)
nHCl = 0,3 . 1 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,1 <--- 0,3 ---> 0,1 ---> 0,15
mAl = 0,1 . 27 = 2,7 (g(
mCu = 9,1 - 2,7 = 6,4 (g)
VH2 = 0,15 . 22,4 = 3,36 (l)

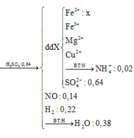
\(3,68g\left\{{}\begin{matrix}Fe\\Mg\end{matrix}\right.+HNO3->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Mg\left(NO3\right)2\end{matrix}\right.+5,376\left(l\right)NO2\)
Bảo toàn e :
\(3x+2y=0,24\)
Ta có :
\(\left\{{}\begin{matrix}56x+24y=3,68\\3x+2y=0,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%mFe=\dfrac{0,04.56}{3,68}=60,87\%\\\%mMg=\dfrac{0,06.24}{3,68}=39,13\%\end{matrix}\right.\)
Bảo toàn nguyên tố Fe và Mg :
\(nFe=nFe\left(NO3\right)3=0,04\left(mol\right)\)
\(nMg=nMg\left(NO3\right)2=0,06\left(mol\right)\)
Ta có : \(nHNO3pu=0,04.3+0,06.2=0,24\left(mol\right)\)
\(\Rightarrow mHNO3=0,24.63=15,12\left(g\right)\)

Đáp án D
Dung dịch X + vừa đủ 0,25 mol NaOH sinh ra 0,12 mol Mg(OH)2.
+ Nhận thấy để tạo 0,12 mol Mg(OH)2 cần dùng 0,24 mol NaOH < 0,25 mol NaOH cần dùng vừa đủ.
Mà đề nói hỗn hợp M tác dụng vừa đủ với axit HNO3 ⇒ HNO3 không thể dư được.
⇒ Chỉ có 1 cách giải thích thỏa đáng đó là nNH4NO3 = 0,25 – 0,24 = 0,01 mol.
Vậy ta có sơ đồ:
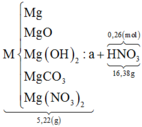
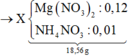
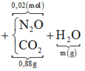
Vì 2 khí có cùng phân tử khối là 44 ⇒ mKhí = 0,02×44 = 0,88 gam.
mMuối = 0,12×148 + 0,01×80 = 18,56 gam.
Vậy bảo toàn khối lượng ta ⇒ mH2O = m = 2,16 gam ⇒ nH2O = 0,12 mol.
ĐẶt nMg(OH)2 = a và bảo toàn hiđro cả quá trình ta có:
2a + 0,26 = 0,01×4 + 0,12×2 ⇔ a = 0,01 mol.
⇒ mMg(OH)2 = 0,01×58 = 0,58 gam.
⇒ %mMg(OH)2 = 0 , 58 × 100 5 , 22 ≈ 11,11%

Chọn đáp án A
nCO2 = 0,24 mol. Bảo toàn khối lượng: mB = 65,76 - 0,24 × 44 = 55,2(g).
► Xét 1 phần ⇒ mB = 27,6(g). Có H2 ⇒ Al dư ⇒ B gồm Al dư, Al2O3 và Fe.
⇒ nAl = 0,06 ÷ 1,5 = 0,04 mol || nAl(OH)3 = 0,28 mol ⇒ nAl2O3 = 0,12 mol.
→ m B nFe = 0,255 mol ⇒ nSO42– = (93,36 - 0,28 × 27 - 0,255 × 56) ÷ 96 = 0,745 mol.
⇒ nH2SO4 = 0,745 mol ⇒ ∑nH+ = 0,745 × 2 + 0,23 = 1,72 mol.
● ∑nH+ = 4nNO + 10nN2O + 2nO ⇒ 4a + 10b = 1. Bảo toàn nguyên tố Nitơ:
a + 2b = 0,23 mol ||⇒ giải hệ có: a = 0,15 mol; b = 0,04 mol.
⇒ a : b = 3,75 ⇒ chọn A.

Đáp án C
* Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2=0,05 mol, n(NO)=0,15 mol nên n(FeCO3)=n(CO2)=0,05 mol.
Đặt nM=a mol, nên n(Fe)=b mol. Ta có: aM+56b+116.0,05=14,1
Nên aM+56b=8,3 (1)
- Dung dịch X2 có : a mol M(NO3)n; (b+0,05) mol Fe(NO3)3, HNO3 dư, có thể có c mol NH4NO3.
+ Phản ứng trung hòa:
HNO3+NaOH→NaNO3+H2O
n(NaOH)= n (HNO3dư)=0,2.1=0,2 mol
- dung dịch X3 có a mol M(NO3)n,( b+0,05) mol Fe(NO3)3, 0,2 mol NaNO3, có thể c mol NH4NO3.
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M+62n)a+242(b+0,05)+80.c+85.0,2=38,3.2=76,6
aM+62an+242b+80c=47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3+3NaOH→3NaNO3+Fe(OH)3
Ta có: 107(b+0,05)=16,05 suy ra b=0,1
Theo bảo toàn electron, ta có: an+ 0,3+0,05=0,45+8c suy ra an=0,1+8c (5)
Từ (1) suy ra aM=2,7 (6)
Từ (2) aM+62an+80c=23,3 (7)
Từ (5), (6), (7) an=0,3; c=0,025 M=9n n=3; M=27 là Al là nghiệm thỏa mãn.
n(HNO3 phản ứng)=nN(sp)=0,1.3+0,15.3+0,025.2+0,15=0,95mol
n(HNO3 bắt đầu)=0,95+0,2=1,15 mol x= CM(HNO3)=2,3M.